Лечение суставов - артроз, артрит, остеохондроз и многое другое
К фибриллярным белкам относятся
Глобулярные и фибриллярные белки. Типы фибриллярных белков
Человеческий организм вмещает больше пятидесяти тысяч белков, которые разнятся между собой по структуре, строению и функциям. Они состоят из разных аминокислот, каждая из них занимает свое положение в цепи полипептидов. На сегодняшний день не существует единой классификации, которая учитывает разные параметры белков. Одни из них отличаются по форме молекул, здесь выделяют глобулярные и фибриллярные белки, о них и пойдет сегодня речь.
Белки глобулярные
Сюда относятся белки такие, в чьих молекулах наблюдаются цепи полипептидов, что имеют шароподобную форму. Такое строение белка связано с гидрофильными (имеют соединения водорода с водой) и гидрофобными (отталкивают воду) взаимодействиями. К данному виду относятся экзимы, гормоны, которые имеют белковую природу, иммуноглобулины, протеиды, альбумины, а также белки, которые выполняют регуляторную и транспортную функции. Это большая часть белков человека.
Экзимы
Экзимы (ферменты) находятся во всех клетках, с их помощью одни вещества превращаются в иные, так как они резко изменяют скорость превращений, способствуя распаду, расщеплению и синтезу веществ из продуктов распада. Во всех протекающих в организме реакциях они играют роль катализатора, регулируют обмен веществ. Известно более пяти тысяч разных ферментов. Все они выполняют до нескольких миллионов действий в секунду. Но они способствуют ускорению определенных реакций, оказывая действие только на определенные вещества. Ферменты удаляют погибшие клетки, шлаки и яды. Они являются катализаторами всех процессов в организме, а если их недостаточно, то у человека увеличивается вес за счет накопления отходов в теле.
Иммуноглобулины
Антитела (иммуноглобулины) представляют собой соединения белков, что появляются вследствие ответной реакции на поступление в организм бактерий и вирусов, а также токсинов. Они не дают им размножаться и нейтрализуют отравляющие вещества. Иммуноглобулины распознают и связывают чужеродные вещества, их уничтожают, образуя иммунные комплексы, а потом удаляют эти комплексы. Также они защищают организм от повторного инфицирования, так как антитела против болезней, которые были перенесены, длительный период сохраняются. Иногда в организме вырабатываются аномальные антитела, что нападают на собственный организм. Происходит это чаще всего из-за наличия аутоиммунных болезней. Таким образом, глобулярные и фибриллярные белки выполняют незаменимые функции в организме человека, поддерживая его нормальную жизнедеятельность.
Гормоны белковой природы
Сюда относятся гормоны поджелудочной, паращитовидной желез и гипофиза (инсулин, глюкагон, СТГ, ТТГ и другие). Одни регулируют углеводный обмен, увеличивая и понижая уровень сахара в крови, другие стимулируют рост клеток и деятельность щитовидной железы, третьи проводят регуляцию половых желез. Таким образом, все они регулируют физиологические функции. Эта их работа сводится либо к ингибированию, либо к активации систем ферментов.
Белки фибриллярные
Фибриллярные белки те, что имеют структуру в виде нити. Они не растворяются в воде и имеют массу молекулы очень большую, структура которой высокорегуляторная, она приходит в устойчивое состояние благодаря взаимодействиям между разными цепями полипептидов. Эти цепи находятся синхронно друг для друга на одной плоскости и создают так называемые фибриллы. К фибриллярным белкам относятся: кератины (волосы и иные роговые покровы), эластин (сосуды и легкие), коллаген (сухожилия и хрящи). Эти все белки выполняют в организме структурную функцию. Также сюда входит миозин (мышечное сокращение) и фибрин (свертывание крови). Этот вид белков выполняет опорные функции, которые придают прочности тканям. Таким образом, все типы фибриллярных белков выполняют незаменимую роль в анатомии и физиологии. Из них образуются защитные покровы человека, также они принимают участие в создании опорных элементов, поскольку входят в состав соединительной ткани, хрящей, сухожилий, костей и глубоких кожных слоев. В воде они не растворяются.
Кератины
К фибриллярным белкам относятся кератины (альфа и бета). Альфа-кератины представляют собой основную группу фибриллярных белков, из них формируются покровы, которые выполняют защитную функцию. Они представлены в сухом весе волос, ногтей, перьев, шерсти, панцирей и так далее. Разные белки имеют сходство в составе аминокислот, они содержат цистеин и имеют цепи полипептидов, которые располагаются одинаково. Бета-кератины содержат аланин и глицин, они входят в состав паутины и шелка. Таким образом, кератины бывают «твердыми» и «мягкими».
В ходе возникновения различий между эпителиальными клетками, в процессе развития особи, они ороговевают, в них приостанавливается обмен веществ, наступает угасание клетки и она ороговевает. Клетки кожи вмещают кератин, он совместно с коллагеном и эластином образует влагонепроницаемый слой эпидермиса, кожа становится упругой и прочной. При натирании и давлении клетки вырабатывают кератин в огромных количествах с защитной целью. Вследствие этого появляются мозоли или наросты. Ороговевшие клетки кожи начинают беспрерывно отшелушиваться и заменяются новыми. Таким образом, бета-кератины играет большую роль для животного мира, так как представляют собой основной компонент рогов и клювов. Альфа-кератины характерны для организма человека, они являются составной частью волос, кожи и ногтей, а также входят в костный скелет, определяя его крепость.
Коллаген
Фибриллярные белки, в частности коллаген с эластином, являются компонентами соединительной ткани, они составляют основную долю хрящей, стенок сосудов, сухожилий и прочего. Коллаген представлен у позвоночных третьей частью всей массы белков. Его молекулы производят полимеры, которые называются коллагеновыми фибриллами. Они очень прочны, выдерживают огромную нагрузку и не растягиваются. Коллаген состоит из глицина, пролина и аланина, в нем нет цистеина и триптофана, а тирозин и метионин присутствуют здесь в малом количестве.
Также большую роль в образовании фибрилл играют гидроксипролин и гидроксилизин. Изменения в строении коллагена приводят к развитию наследственных заболеваний. Коллагены очень прочны, они не растягиваются. Для каждой ткани присущи свои типы коллагенов. Этот белок выполняет множество функций:
- защитную, характеризующуюся обеспечением прочности тканей и их защитой от травм;
- опорную, обусловленную скреплением органов и формированием их форм;
- восстановительную, характеризующуюся регенерацией на клеточном уровне.
Также коллагены придают тканям эластичности, предотвращают развитие меланом кожи, участвуют в образовании оболочек клеток.
Эластин
Выше мы рассмотрели, какие белки относятся к фибриллярным. Еще сюда включают эластин, что имеет резиноподобные свойства. Его нити, которые находятся в легочной ткани, сосудистых стенках и связках, могут растягиваться во много раз больше своей обычной длины. После того, как нагрузка прекращает свое воздействие, они возвращаются в первичное положение. В составе эластина больше всего содержится пролина и лизина, гидроксилизина здесь нет. Таким образом, функции фибриллярных белков очевидны. Они играют большую роль в развития организма. Эластин обеспечивает растяжение и сжатие органов, артерий, сухожилий, кожи и прочего. Он помогает органам восстанавливать первоначальные размеры после растяжения. Если в организме человека недостает эластина, то у него образуются кардиоваскулярные изменения в виде аневризм, дефектов клапанов сердца и так далее.
Сравнение глобулярных и фибриллярных белков
Эти две группы белков разнятся между собой по форме молекул. Глобулярные белки имеют цепи полипептидов, что скручены очень плотно в овальные структуры. Фибриллярные белки имеют цепи полипептидов, которые находятся параллельно друг другу и образуют слой. По механическим свойствам ГБ не сжимаются и не распрямляются, а ФБ, наоборот, имеют такую способность. ГБ не растворяются в воде, а ФБ растворяются. Также эти белки разнятся по своим функциям. Первые выполняют функцию динамическую, а вторые – структурную. Глобулярные белки могут быть представлены в виде ферментов и антител, а также гемоглобина, инсулина и прочего. Примеры фибриллярных белков: коллаген, кератин, фиброин и прочие. Все эти виды белков незаменимы, недостаточное их количество в организме приводит к серьезным нарушениям и патологиям.
Таким образом, глобулярные и фибриллярные белки выполняют незаменимую роль в нормальной жизнедеятельности организма позвоночных. Они обеспечивают деятельность органов, тканей, кожи и прочего, выполняют множество функций, необходимых для полноценного развития организма.
fb.ru
1.9 Глобулярные и фибриллярные белки
20Глава 1 Аминокислоты и белки
3.Трехмерная структура многих олигомерных белков меняется, когда белок связывается с лигандами. Иными словами, третичная и четвертичная структура таких белков изменчива, и это — ключ к регуляции их активности.
4.У некоторых белков есть общие субъединицы. Это можно объяснить тем, что в ходе эволюции субъединицы образовывали новые комбинации и это более оправданно, чем создание нового мономерного белка с той же функцией.
5.Полисубъединичные белки могут катализировать несколько последовательных реакций, в которых продукт первой реакции становится субстратом для второй. Пример: ПДГ (пируватдегидрогеназный комплекс).
Белки разделяют на две группы по их общей морфологии: глобулярные и фибриллярные. Отличия между фибриллярными и глобулярными белками приведены в таблице ниже. Третичная структура глобулярных белков представляет глобулу (или клубок) и имеет сферическую или округлую форму. Третичная структура фибриллярных белков имеет форму узкой закрученной нити. Кератин и коллаген — примеры фибриллярных белков.
Таблица 3 | Глобулярные и фибриллярные белки | |
Фибриллярные белки | Глобулярные белки | |
Третичная | Представляет собой длинные, узкие | Имеет округлую, сферическую |
структура | закрученные нити | форму |
Растворимость | Нерастворимы | Отчасти растворимы (образуют кол- |
лоидные растворы) | ||
Примеры | Коллаген (кожа, кости, зубы, сухожи- | Гемоглобин (в эритроцитах), инсу- |
лия), кератин (волосы, ногти) | лин (гормон поджелудочной же- | |
лезы), каталаза (обеспечивает рас- | ||
пад пероксида водорода в живых | ||
клетках) | ||
Структура | Коллаген существует в виде тройной |
и функции | спирали, механически стойкой и |
прочной. Его содержание особенно | |
высоко в сухожилиях, связках, со- | |
единительной ткани, мышцах, коже и | |
других тканях, испытывающих на | |
себе сильное механическое воздей- | |
ствие. | |
Выполняют различные функции в клетках. Хорошо растворимы, поскольку на поверхности белковой молекулы расположены преимущественно полярные аминокислоты, а неполярные аминокислоты скрыты в ядре белка. Полярные аминокислоты участвуют в диполь-дипольных взаимодействиях с молекулами растворителя.
Глобулярные и фибриллярные белки 21
А Кератин
Кератин является механически прочным и химически неактивным белком. Он обнаружен у большинства позвоночных и представляет собой важный компонент внешнего эпидермального слоя и различных структур: волос, рогов, ногтей и перьев. Кератины классифицируют на 2 основные группы: α-кератины (у человека) и β-ке- ратины (у птиц и рептилий). Геном человека содержит ~50 генов, кодирующих тканеспецифичные кератины.
Кератин имеет очень сложную структуру, отличающуюся от той, которую имеют глобулярные белки.
Первичная структура α -кератина точно так же представляет собой цепочку аминокислотных остатков. Центральный сегмент каждой полипептидной цепи α-ке- ратина имеет псевдоповтор из 7 аминокислотных остатков: a-b-c-d-e-f-g. В позициях -a- и -d- чаще всего находятся гидрофобные аминокислотные остатки (см. Рис. 17 ). Поскольку на один виток α-спирали приходится ~3,6 остатка, аминокислотные остатки -a- и -d- расположены всегда по одну сторону цепи. Это позволяет двум полипептидным цепям образовывать димеры (в рамках надвторичной структуры). Кроме того, α-кератины содержат остатки цистеина, между которыми образуются прочные дисульфидные связи. Они стабилизируют общую структуру кератина, связывая между собой полипептидные цепи.
Вторичная структура α-кератина очень похожа на обычную α-спираль, однако в α-кератине она имеет меньший шаг (~5,1 Å), а значит, более плотную упаковку. Это вызвано тем, что в α-кератине две полипептидные цепи оборачиваются относительно друг друга и формируют закрученную нить, одновременно вызывая небольшие структурные изменения в цепях (см. Рис. 18 ▼).
Рис. 17. | Расположение гидрофобных | Рис. 18. | Закрученная нить кератина |
остатков -a- и -d- в цепях кератина. | (формируется из двух полипептидных це- | ||
пей). |
Более высокие уровни структурной организации кератина ещё не так хорошо изучены. В целом всю структуру α-кератина можно представить следующим образом (включая высшие уровни структурной организации) (см. Рис. 19 ▼):
studfiles.net
Фибриллярный белок: структура, примеры
По особенности укладки в трехмерном пространстве различают две большие группы белков: глобулярные и фибриллярные. Большинство протеинов относится к первой фракции, которая соответствует типичной модели третичной структуры, описывающей аминокислотную цепь как сферический клубок с гидрофобным центром и гидрофильной поверхностью. Фибриллярные белки — это специфическая группа, характеризующаяся нитевидной формой молекул.
Общая характеристика пространственной структуры белка
В первоначальном виде синтезированный белок представляет собой линейную цепочку аминокислот, соединенных друг с другом пептидными связями. Однако на пути к конечной функциональной форме молекула претерпевает несколько стадий пространственной укладки за счет различных химических взаимодействий. Каждый этап формирования обозначен соответствующими структурами: первичной, вторичной, третичной и четвертичной (если имеется).
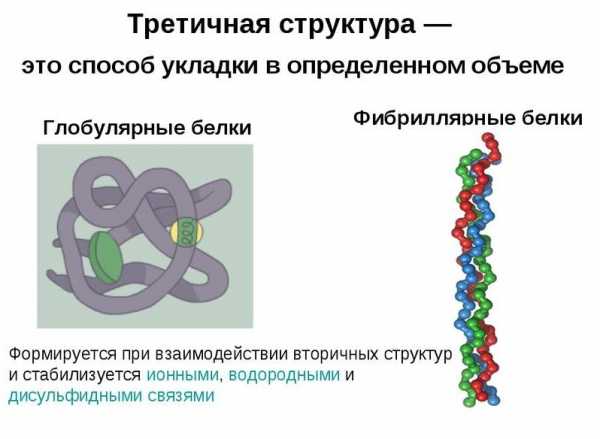
Глобулярные белки характеризуются трехмерной пространственной конформацией, которая удерживается комплексом слабых химических связей (водородные, ионные, гидрофобные и т. д.). По форме молекула такого протеина напоминает сферический клубок.
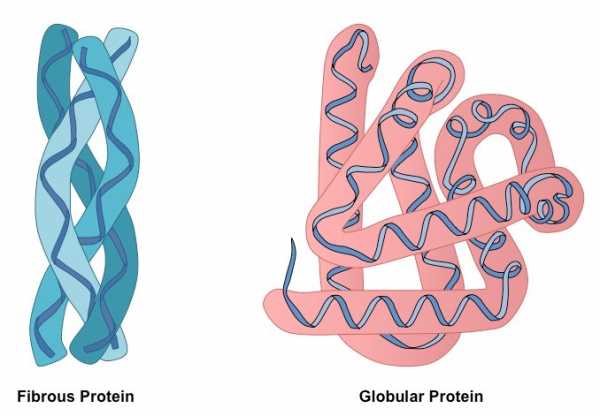
Полипептидные цепи фибриллярных белков формируют длинные волокна, которые состоят из повторяющихся элементов вторичной структуры. Устройство третичной конформации нитевидных протеинов по сравнению с глобулой значительно примитивнее, однако обеспечивает хорошую стабильность.
Основные отличия нитевидных белков от сферических
Кроме пространственной формы, фибриллярные белки отличаются от глобулярных по:
- размеру;
- растворимости;
- функциям.
Волокнистые протеины обычно крупнее сферических и представляют собой длинные стержни, сформированные из спиралей. В отличие от глобулярных белков, пространственная конформация фибриллярных обеспечивается за счет сильных водородных связей. По этой причине волокнистые протеины более стабильны и не так легко денатурируют, как сферические.
В отличие от глобулярных белков, фибриллярные:
- не растворяются в воде, а также слабых кислотах и основаниях;
- растворимы в сильных щелочах и кислотах;
- обладают свойствами растяжимости и сжатия;
- характеризуются высокой устойчивостью к пищеварительным ферментам.
Глобулярные белки построены из прямых участков вторичных структур, которые при соединении друг с другом резко меняют направление, формируя трехмерный клубок. Волокнистые протеины состоят из одного элемента, повторяющегося много раз.
Особенности фибриллярных протеинов
Разнообразие фибриллярных белков значительно меньше, чем глобулярных. Эта группа представляет собой специализированную фракцию протеинов, выполняющих преимущественно структурные функции. При этом фибриллярные белки работают на макроуровне, формируя крупные надмолекулярные комплексы.
Волокнистые протеины были идентифицированы только у животных. Эти белки выполняют функцию опорных компонентов некоторых тканей. Такая биологическая роль предъявляет повышенные требования к прочности и упорядоченности построения молекул. По этой причине фибриллярная структура белка отличается большей стабильностью по сравнению с глобулой.
Волокнистые протеины участвуют в формировании жестких структур, таких как:
- соединительная ткань;
- сухожилия;
- мышечные волокна.
Эти белки входят в состав различных покровных образований (эпидермис, волосы, шерсть и т. д.), выполняя защитные функции.
В естественной физиологической среде фибриллярные белки не присутствуют в растворе. Однако, если искусственно смешать молекулы волокнистого протеина с водой, образуется очень вязкая масса.
Примеры фибриллярных и глобулярных белков
К глобулярным белкам можно отнести все протеины, растворенные в межклеточной и внутриклеточной средах, а также в плазме крови. Сюда относят ферменты, белковые гормоны, факторы транскрипции, иммуноглобулины и так далее. Классическим образцом глобулярного белка можно назвать гемоглобин.
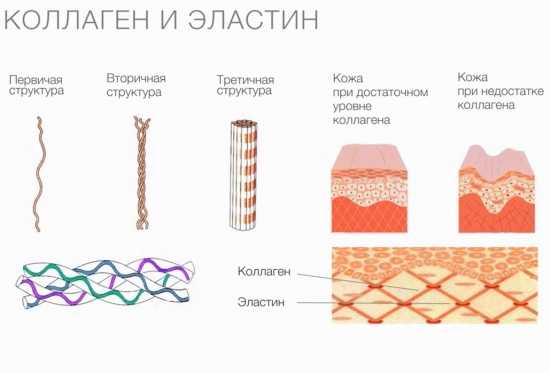
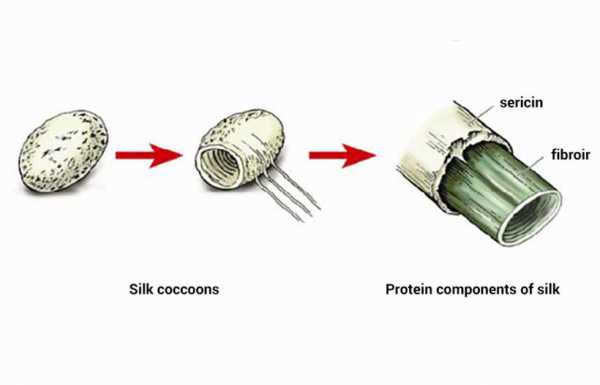
Сферические протеины выполняют множество функций, тогда как волокнистые — только структурную. Типичным примером фибриллярных белков являются коллаген, эластин и кератины. К группе волокнистых протеинов относят также фиброин, из которого состоит шелковая нить, и фибрин, формирующийся при полимеризации фибриногена в процессе свертывания крови.
Коллаген — самый распространенный фибриллярный протеин многоклеточных животных. Он входит в состав соединительной ткани, обеспечивая ее прочность и эластические свойства. Этот белок присутствует в:
- хрящах;
- дерме;
- сухожилиях;
- органическом матриксе костей;
- стенках сосудов;
- органическом материале костной ткани.
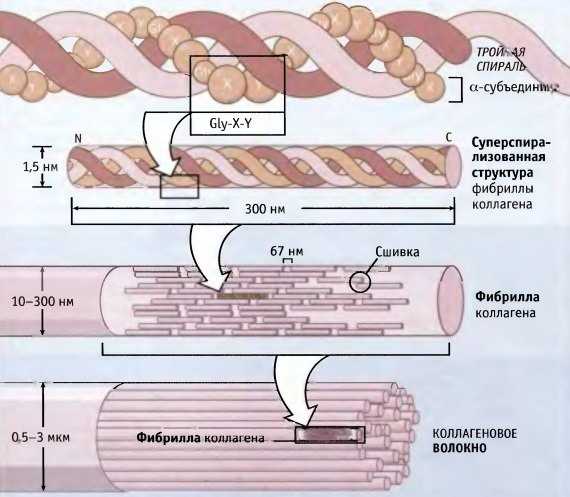
Коллаген состоит из трех аминокислотных цепей, скрученных в спираль и соединенных друг с другом ковалентными связями. Структурные единицы этого белка называются тропоколлагенами. Последние соединяются друг с другом концами, смещенными друг относительно друга на расстояние в 67 нанометров.
В зависимости от локализации в организме различают 28 типов коллагена. У всех разновидностей обязательно присутствует хотя бы один домен с тройной спиралью. Коллаген составляет основу всех типов соединительной ткани. Структурные компоненты этого белка образуют очень прочные фибриллы, которые способны выдерживать значительные нагрузки.
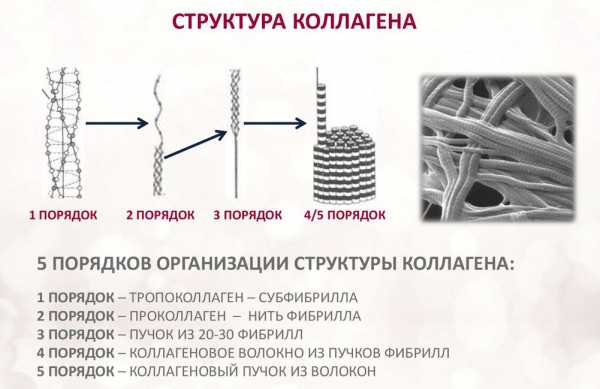
Коллаген выполняет опорные и защитные функции, а также обеспечивает эластичность тканей. Однако молекулы этого протеина не обладают способностью растягиваться. Резиноподобные свойства характерны для другого белка, также присутствующего в соединительных тканях, — эластина.
Кератины
Выделяют 2 основных разновидности кератинов: альфа и бета. В первую группу входят волокнистые белки, входящие в состав покровных образований позвоночных. Альфа-кератины составляют большую часть сухой массы:
- эпидермиса;
- волос и шерсти;
- когтей и ногтей;
- копыт, рогов, панцирей, игл и т. д.
Иными словами, кератины альфа-группы являются структурной основной для формирования производных кожи. Бета-разновидность этого типа волокнистых белков входит в состав паутины и шелка. Эти кератины более мягкие.
Жесткие белки альфа-группы выполняют защитные функции, а также обеспечивают прочность определенных анатомических частей (рога, копыта, клювы). За счет кератина происходит образование мозолей на поврежденной коже.
Эластин
Эластин — основной белковый компонент тканей, которые должны обладать высокими пластическими свойствами. Этот протеин входит в состав:
- артерий;
- легких;
- стенок мочевого пузыря;
- кожи;
- эластичных связок;
- хряща.
Как и другие фибриллярные белки, эластин строится из элементарных повторяющихся единиц. В этом случае в их качестве выступают небольшие молекулы весом 65 килодальтон, которые сшиваются с образованием нерастворимого комплекса. Каждая структурная единица называется протоэластином.
www.nastroy.net
Фибриллярные белки - это... Что такое Фибриллярные белки?
ФИБРИЛЛЯРНЫЕ БЕЛКИ — белки, полипептидные цепи к рых, располагаясь упорядоченно относительно одной оси, образуют длинные волокна (фибриллы) или слои. Устойчивы к действию протео литич. ферментов. К Ф. б. относятся осн. структурные белки соединит, ткани животных… … Биологический энциклопедический словарь
ФИБРИЛЛЯРНЫЕ БЕЛКИ — образованы полипептидными цепями, которые расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слой. Нерастворимы в воде и растворах солей. Основные структурные элементы соединительной ткани (коллаген и… … Большой Энциклопедический словарь
фибриллярные белки — – белки, имеющие волокнистое строение и высокую механическую прочность, не растворимые в воде … Краткий словарь биохимических терминов
фибриллярные белки — образованы полипептидными цепями, которые расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слой. Нерастворимы в воде и растворах солей. Основные структурные элементы соединительной ткани… … Энциклопедический словарь
ФИБРИЛЛЯРНЫЕ БЕЛКИ — образованы полипептидными цепями, к рые расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слой. Нерастворимы в воде и р рах солей. Осн. структурные элементы соединит. ткани (коллаген и др.). Ср.… … Естествознание. Энциклопедический словарь
БЕЛКИ (органические соединения) — БЕЛКИ, высокомолекулярные органические соединения, биополимеры, построенные из 20 видов L a аминокислотных остатков, соединенных в определенной последовательности в длинные цепи. Молекулярная масса белков варьируется от 5 тыс. до 1 млн. Название… … Энциклопедический словарь
Белки — I Белки (протеины) органические соединения, структурной основой которых служит полипептидная цепь, состоящая из аминокислотных остатков, соединенных пептидными связями ( СО Nh3 ) в определенной последовательности. Белки являются главными… … Медицинская энциклопедия
Белки — У этого термина существуют и другие значения, см. Белки (значения). Белки (протеины, полипептиды[1]) высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа аминокислот. В живых организмах… … Википедия
белки — 1. БЕЛКИ, ов; мн. (ед. белок, лка; м.). 1. Выпуклые непрозрачные оболочки глаз белого цвета. Б. у неё голубоватые. 2. Разг. сниж. О глазах. Вращать белками. ◁ Белочный, ая, ое. Б ые оболочки глаз. 2. БЕЛКИ, ов; мн. (ед. белок, лка; м.). Сложные… … Энциклопедический словарь
БЕЛКИ — природные высокомолекулярные органические соединения, построенные из остатков 20 аминокислот, которые соединены пептидными связями в длинные цепи. Молекулярная масса от нескольких тысяч до нескольких миллионов. В зависимости от формы белковой… … Большой Энциклопедический словарь
dic.academic.ru
ФИБРИЛЛЯРНЫЕ БЕЛКИ - это... Что такое ФИБРИЛЛЯРНЫЕ БЕЛКИ?
Фибриллярные белки — Фибриллярные белки белки, имеющие вытянутую нитевидную структуру, в которой отношение поперечной оси к продольной больше 1:10. Большинство фибриллярных белков не растворяется в воде, имеет большую молекулярную массу и высоко регулярную… … Википедия
ФИБРИЛЛЯРНЫЕ БЕЛКИ — образованы полипептидными цепями, которые расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слой. Нерастворимы в воде и растворах солей. Основные структурные элементы соединительной ткани (коллаген и… … Большой Энциклопедический словарь
фибриллярные белки — – белки, имеющие волокнистое строение и высокую механическую прочность, не растворимые в воде … Краткий словарь биохимических терминов
фибриллярные белки — образованы полипептидными цепями, которые расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слой. Нерастворимы в воде и растворах солей. Основные структурные элементы соединительной ткани… … Энциклопедический словарь
ФИБРИЛЛЯРНЫЕ БЕЛКИ — образованы полипептидными цепями, к рые расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слой. Нерастворимы в воде и р рах солей. Осн. структурные элементы соединит. ткани (коллаген и др.). Ср.… … Естествознание. Энциклопедический словарь
БЕЛКИ (органические соединения) — БЕЛКИ, высокомолекулярные органические соединения, биополимеры, построенные из 20 видов L a аминокислотных остатков, соединенных в определенной последовательности в длинные цепи. Молекулярная масса белков варьируется от 5 тыс. до 1 млн. Название… … Энциклопедический словарь
Белки — I Белки (протеины) органические соединения, структурной основой которых служит полипептидная цепь, состоящая из аминокислотных остатков, соединенных пептидными связями ( СО Nh3 ) в определенной последовательности. Белки являются главными… … Медицинская энциклопедия
Белки — У этого термина существуют и другие значения, см. Белки (значения). Белки (протеины, полипептиды[1]) высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа аминокислот. В живых организмах… … Википедия
белки — 1. БЕЛКИ, ов; мн. (ед. белок, лка; м.). 1. Выпуклые непрозрачные оболочки глаз белого цвета. Б. у неё голубоватые. 2. Разг. сниж. О глазах. Вращать белками. ◁ Белочный, ая, ое. Б ые оболочки глаз. 2. БЕЛКИ, ов; мн. (ед. белок, лка; м.). Сложные… … Энциклопедический словарь
БЕЛКИ — природные высокомолекулярные органические соединения, построенные из остатков 20 аминокислот, которые соединены пептидными связями в длинные цепи. Молекулярная масса от нескольких тысяч до нескольких миллионов. В зависимости от формы белковой… … Большой Энциклопедический словарь
dic.academic.ru
1.9 Глобулярные и фибриллярные белки
20Глава 1 Аминокислоты и белки
3.Трехмерная структура многих олигомерных белков меняется, когда белок связывается с лигандами. Иными словами, третичная и четвертичная структура таких белков изменчива, и это — ключ к регуляции их активности.
4.У некоторых белков есть общие субъединицы. Это можно объяснить тем, что в ходе эволюции субъединицы образовывали новые комбинации и это более оправданно, чем создание нового мономерного белка с той же функцией.
5.Полисубъединичные белки могут катализировать несколько последовательных реакций, в которых продукт первой реакции становится субстратом для второй. Пример: ПДГ (пируватдегидрогеназный комплекс).
Белки разделяют на две группы по их общей морфологии: глобулярные и фибриллярные. Отличия между фибриллярными и глобулярными белками приведены в таблице ниже. Третичная структура глобулярных белков представляет глобулу (или клубок) и имеет сферическую или округлую форму. Третичная структура фибриллярных белков имеет форму узкой закрученной нити. Кератин и коллаген — примеры фибриллярных белков.
Таблица 3 | Глобулярные и фибриллярные белки | ||
Фибриллярные белки | Глобулярные белки | ||
Третичная | Представляет собой длинные, узкие | Имеет | округлую, сферическую |
структура | закрученные нити | форму | |
Растворимость | Нерастворимы | Отчасти растворимы (образуют кол- | |
лоидные растворы) | |||
Примеры | Коллаген (кожа, кости, зубы, сухожи- | Гемоглобин (в эритроцитах), инсулин | |
лия), кератин (волосы, ногти) | (гормон поджелудочной железы), | ||
каталаза (обеспечивает распад пе- | |||
роксида водорода в живых клетках) | |||
Структура | Коллаген существует в виде тройной | Выполняют различные функции в | |
и функции | спирали, механически стойкой и | клетках. Хорошо растворимы, по- | |
прочной. Его содержание особенно | скольку | на поверхности белковой | |
высоко в сухожилиях, связках, соеди- | молекулы расположены преимуще- | ||
нительной ткани, мышцах, коже и | ственно полярные аминокислоты, а | ||
других тканях, испытывающих на | неполярные аминокислоты скрыты в | ||
себе сильное механическое воздей- | ядре белка. Полярные аминокис- | ||
ствие. | лоты участвуют в диполь-дипольных | ||
взаимодействиях с молекулами рас- | |||
творителя. | |||
Глобулярные и фибриллярные белки 21
А Кератин
Кератин является механически прочным и химически неактивным белком. Он обнаружен у большинства позвоночных и представляет собой важный компонент внешнего эпидермального слоя и различных структур: волос, рогов, ногтей и перьев. Кератины классифицируют на 2 основные группы: α-кератины (у человека) и β-ке- ратины (у птиц и рептилий). Геном человека содержит ~50 генов, кодирующих тканеспецифичные кератины.
Кератин имеет очень сложную структуру, отличающуюся от той, которую имеют глобулярные белки.
Первичная структура α -кератина точно так же представляет собой цепочку аминокислотных остатков. Центральный сегмент каждой полипептидной цепи α-ке- ратина имеет псевдоповтор из 7 аминокислотных остатков: a-b-c-d-e-f-g. В позициях -a- и -d- чаще всего находятся гидрофобные аминокислотные остатки (см. Рис. 17 ). Поскольку на один виток α-спирали приходится ~3,6 остатка, аминокислотные остатки -a- и -d- расположены всегда по одну сторону цепи. Это позволяет двум полипептидным цепям образовывать димеры (в рамках надвторичной структуры). Кроме того, α-кератины содержат остатки цистеина, между которыми образуются прочные дисульфидные связи. Они стабилизируют общую структуру кератина, связывая между собой полипептидные цепи.
Вторичная структура α-кератина очень похожа на обычную α-спираль, однако в α-кератине она имеет меньший шаг (~5,1 Å), а значит, более плотную упаковку. Это вызвано тем, что в α-кератине две полипептидные цепи оборачиваются относительно друг друга и формируют закрученную нить, одновременно вызывая небольшие структурные изменения в цепях (см. Рис. 18 ▼).
Рис. 17. | Расположение гидрофобных | Рис. 18. | Закрученная нить кератина |
остатков -a- и -d- в цепях кератина. | (формируется из двух полипептидных це- | ||
пей). |
Более высокие уровни структурной организации кератина ещё не так хорошо изучены. В целом всю структуру α -кератина можно представить следующим образом (включая высшие уровни структурной организации) (см. Рис. 19 ▼):
studfiles.net
Фибриллярный белок - это... Что такое Фибриллярный белок?
фибриллярный белок — fibrilinis baltymas statusas T sritis chemija apibrėžtis Baltymas, kurio polipeptidinės grandinės sudaro plaušelius. atitikmenys: angl. fibrous protein rus. фибриллярный белок … Chemijos terminų aiškinamasis žodynas
Мезенхимальные диспротеинозы — (сосудисто стромальные диспротеинозы) дисметаболические (дистрофические) процессы, характеризующиеся преимущественным нарушением белкового обмена и первично развивающиеся в строме органов. Традиционно наряду с мезенхимальными диспротеинозами как… … Википедия
фиброин — а; м. [от лат. fibra волокно] Спец. Нерастворимый белок, составляющий основную массу натурального шёлка сырца (представляет собой вязкую сиропообразную жидкость, затвердевающую на воздухе в прочную нерастворимую нить). * * * фиброин нерастворимый … Энциклопедический словарь
Полимер — (Polymer) Определение полимера, виды полимеризации, синтетические полимеры Информация об определении полимера, виды полимеризации, синтетические полимеры Содержание Содержание Определение Историческая справка Наука о Полимеризация Виды… … Энциклопедия инвестора
Белки — I Белки (протеины) органические соединения, структурной основой которых служит полипептидная цепь, состоящая из аминокислотных остатков, соединенных пептидными связями ( СО Nh3 ) в определенной последовательности. Белки являются главными… … Медицинская энциклопедия
коллаген — а; м. [от греч. kolla клей и genēs рождающий, рождённый]. Белковое вещество, входящее в состав волокон соединительной ткани (сухожилий, костей). * * * коллаген (от греч. kólla клей и ...ген), фибриллярный белок, составляющий основу… … Энциклопедический словарь
флагеллин — специфический фибриллярный белок, содержащийся в жгутиках бактерий, архей. (Источник: «Микробиология: словарь терминов», Фирсов Н.Н., М: Дрофа, 2006 г.) Флагеллин фибриллярный белок, из к рого построены жгутики бактерий. Ф. сальмонелл имеет м.м.… … Словарь микробиологии
ПОЛИМЕРЫ БИОЛОГИЧЕСКИЕ — (биополимеры) природные макромолекулы, играющие осн. роль в биол. процессах. К П. б. относятся белки, нуклеиновые кислоты (НК) и полисахариды. П. б. образуют структурную основу всех живых организмов; все процессы в клетке связаны с… … Физическая энциклопедия
КОЛЛАГЕН — (от греч. kolla клей и genes рождающий, рожденный), фибриллярный белок, составляющий основу соединит, ткани животных (кожи, связок, сухожилий, костей, хрящей и др.) и обеспечивающий ее прочность. К., или тропоколлаген, наиб. распространенный… … Химическая энциклопедия
коллаген — collagen коллаген. Фибриллярный белок, составляющий основу коллагеновых волокон и обеспечивающий прочность соединительных тканей (кость, сухожилие, хрящ и т.п.); К. свойственен многоклеточным животным (у млекопитающих наиболее часто встречающийся … Молекулярная биология и генетика. Толковый словарь.
dic.academic.ru