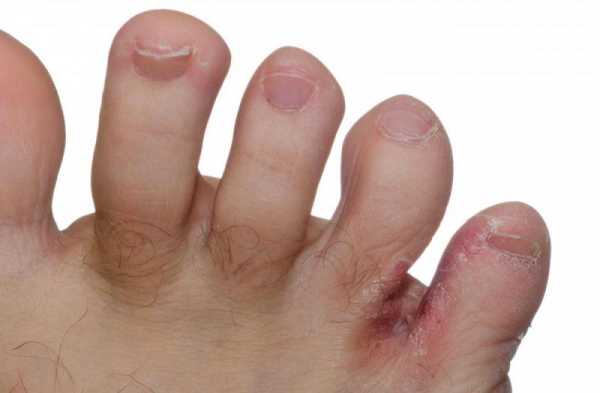
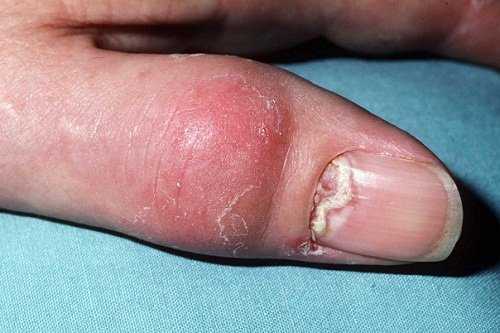
Лечение суставов - артроз, артрит, остеохондроз и многое другое
Антибиотики изобрели в каком году
Изобретатель антибиотиков или история спасения человечества
Сложно представить сейчас, что такие заболевания как пневмония, туберкулёз и ЗППП всего 80 лет назад означали смертный приговор для пациента. Действенных лекарственных средств против инфекций не было, и люди умирали тысячами и сотнями тысяч. Ситуация становилась катастрофичной в периоды эпидемий, когда в результате вспышки тифа или холеры гибло население целого города.
Сегодня в каждой аптеке антибактериальные препараты представлены в широчайшем ассортименте, а вылечить с их помощью можно даже такие грозные болезни, как менингит и сепсис (общее заражение крови). Далёкие от медицины люди редко задумываются о том, когда изобрели первые антибиотики, и кому человечество обязано спасением огромного количества жизней. Ещё труднее представить, как лечили инфекционные болезни до этого революционного открытия.
Жизнь до антибиотиков
Ещё из курса школьной истории многие помнят, что продолжительность жизни до эпохи Новейшего времени была очень небольшой. Дожившие до тридцатилетнего возраста мужчины и женщины считались долгожителями, а процент детской смертности достигал невероятных значений.
Роды были своеобразной опасной лотереей: так называемая родильная горячка (инфицирование организма роженицы и смерть от сепсиса) считалась обычным осложнением, а лекарств от неё не было.
Ранение, полученное в сражении (а воевали люди во все времена много и практически постоянно), приводило обычно к смерти. И чаще всего не потому, что повреждались жизненно важные органы: даже травмы конечностей означали воспаление, заражение крови и смерть.
Древняя история и Средневековье
Древний Египт: заплесневевший хлеб как антисептикТем не менее, люди с древних времён знали о целебных свойствах некоторых продуктов в отношении инфекционных заболеваний. Например, ещё 2500 лет назад в Китае забродившая соевая мука использовалась для лечения гнойных ран, а ещё раньше индейцы майя с той же целью применяли плесень с особого вида грибов.
В Египте времён строительства пирамид заплесневевший хлеб являлся прототипом современных антибактериальных средств: повязки с ним значительно повышали шанс выздоровления в случае ранения. Использование плесневых грибов имело чисто практический характер до тех пор, пока учёные не заинтересовались теоретической стороной вопроса. Однако до изобретения антибиотиков в их современном виде было ещё далеко.
Новое время
Джозеф ЛистерВ эту эпоху наука стремительно развивалась во всех направлениях, и медицина исключением не стала. Причины гнойных инфекций в результате ранения или оперативного вмешательства описал в 1867 году Д. Листер, хирург из Великобритании.
Именно он установил, что возбудителями воспаления являются бактерии, и предложил способ борьбы с ними при помощи карболовой кислоты. Так возникла антисептика, которая ещё долгие годы оставалась единственным более или менее успешным методом профилактики и лечения нагноений.
Краткая история открытия антибиотиков: пенициллина, стрептомицина и остальных
Врачи и исследователи отмечали низкую эффективность антисептиков в отношении возбудителей, проникших глубоко в ткани. Кроме того, действие лекарств ослаблялось биологическими жидкостями пациента и было коротким. Требовались более действенные препараты, и учёные всего мира активно работали в данном направлении.
В каком веке изобрели антибиотики?
Явление антибиоза (способности одних микроорганизмов уничтожать другие) было открыто в конце 19 столетия.
- В 1887 году один из основоположников современной иммунологии и бактериологии – всемирно известный французский химик и микробиолог Луи Пастер – описал губительное действие почвенных бактерий на возбудителя туберкулёза.
- Опираясь на его исследования, итальянец Бартоломео Гозио в 1896 году получил в ходе экспериментов микофеноловую кислоту, ставшую одним из первых антибактериальных средств.
- Чуть позже (в 1899) немецкие врачи Эммерих и Лов открыли пиоценазу, подавляющую жизнедеятельность возбудителей дифтерии, тифа и холеры.
- А ранее – в 1871 году – российские врачи Полотебнов и Манассеин обнаружили губительное действие плесневых грибов на некоторые болезнетворные бактерии и новые возможности в терапии венерических заболеваний. К сожалению, их идеи, изложенные в совместном труде «Патологическое значение плесени», не обратили на себя должного внимания и на практике широко не применялись.
- В 1894 году И. И. Мечников обосновал практическое использование кисломолочных продуктов, содержащих ацидофильные бактерии, для лечения некоторых кишечных расстройств. Это позднее подтвердили практические исследования русского учёного Э. Гартье.
Тем не менее, эпоха антибиотиков началась в 20 веке с открытия пенициллина, положившего начало настоящей революции в медицине.
Изобретатель антибиотиков
Александр Флеминг — первооткрыватель пенициллинаИмя Александра Флеминга известно из школьных учебников биологии даже далёким от науки людям. Именно он считается первооткрывателем вещества с антибактериальным действием – пенициллина. За неоценимый вклад в науку в 1945 году британский исследователь получил Нобелевскую премию. Интерес для широкой публики представляют не только подробности сделанного Флемингом открытия, но и жизненный путь учёного, а также особенности его личности.
Родился будущий лауреат Нобелевской премии в Шотландии на ферме Лохвильд в многодетной семье Хуга Флеминга. Образование получать Александр начал в Дарвеле, где проучился до двенадцатилетнего возраста. Через два года обучения в академии Килмарнок перебрался в Лондон, где жили и работали старшие братья. Юноша трудился клерком, одновременно являясь студентом Королевского Политехнического института. Заниматься медициной Флеминг решил по примеру брата Томаса (врача-офтальмолога).
Поступив в медицинскую школу при госпитале Святой Марии, Александр в 1901 году получил стипендию этого учебного заведения. Поначалу молодой человек не отдавал выраженного предпочтения какой-либо конкретной области медицины. Его теоретические и практические работы по хирургии в годы учебы свидетельствовали о недюжинном таланте, однако Флеминг не чувствовал особого пристрастия к работе с «живым телом», благодаря чему и стал изобретателем пенициллина.
Судьбоносным для молодого врача оказалось влияние Алмрота Райта – известного профессора патологии, приехавшего в 1902 году в госпиталь.
Алмрот РайтРанее Райт разработал и успешно применил вакцинацию от брюшного тифа, однако его интерес к бактериологии этим не ограничился. Он создал группу молодых перспективных специалистов, в которую попал и Александр Флеминг. Получив в 1906 году ученую степень, он был приглашен в команду и работал в исследовательской лаборатории больницы всю свою жизнь.
В годы Первой мировой войны молодой ученый служил в Королевской исследовательской армии в звании капитана. В период боевых действий и позднее, в созданной Райтом лаборатории, Флеминг изучал последствия ранений взрывчатыми веществами и способы профилактики и лечения гнойных инфекций. А пенициллин открыл сэр Александр уже 28 сентября 1928 года.
Читайте далее: Алкоголь — злейший враг антибиотиков.Все о совместимости!
Необычная история открытия
Не секрет, что многие важные открытия были сделаны случайным образом. Однако для исследовательской деятельности Флеминга фактор случайности имеет особое значение. Еще в 1922 году он совершил свое первое значительное открытие в области бактериологии и иммунологии, простудившись и чихнув в чашку Петри с посевами болезнетворных бактерий. Через некоторое время ученый обнаружил, что в месте попадания его слюны колонии возбудителя погибли. Так был открыт и описан лизоцим – антибактериальное вещество, содержащееся в слюне человека.
Так выглядит чаша Петри с пророщенными грибами Penicillium notatum.Не менее случайным образом мир узнал и о пенициллине. Здесь нужно отдать должное халатному отношению персонала к санитарно-гигиеническим требованиям. То ли чашки Петри были плохо вымыты, то ли споры плесневого гриба были занесены из соседней лаборатории, но в результате на посевы стафилококка попал Penicillium notatum. Еще одной счастливой случайностью стал длительный отъезд Флеминга. Будущего изобретателя пенициллина месяц не было в госпитале, благодаря чему плесень успела вырасти.
Вернувшись на работу, ученый обнаружил последствия неряшливости, однако не стал сразу выбрасывать испорченные образцы, а пригляделся к ним внимательнее. Обнаружив, что вокруг выросшей плесени колонии стафилококка отсутствуют, Флеминг заинтересовался этим явлением и начал изучать его детально.
Ему удалось определить вещество, вызвавшее гибель бактерий, которое он назвал пенициллином. Понимая важность своего открытия для медицины, британец посвятил более десяти лет исследованиям этого вещества. Были опубликованы работы, в которых он обосновывал уникальные свойства пенициллина, признавая, однако, что на данной стадии препарат непригоден для лечения людей.
Пенициллин, полученный Флемингом, доказал свою бактерицидную активность в отношении многих грамотрицательных микроорганизмов и безопасность для людей и животных. Тем не менее, препарат был нестабилен, терапия требовала частого введения огромных доз. Кроме того, в нем присутствовало слишком много белковых примесей, дававших негативные побочные эффекты. Эксперименты по стабилизации и очистке пенициллина велись британским ученым с тех пор, как самый первый антибиотик был открыт и вплоть до 1939-го года. Однако к положительным результатам они не привели, и Флеминг охладел к идее использования пенициллина для лечения бактериальных инфекций.
Изобретение пенициллина
Второй шанс открытый Флемингом пенициллин получил в 1940-м году.
В Оксфорде Говард Флори, Норман У. Хитли и Эрнст Чейн, объединив свои познания в химии и микробиологии, занялись получением пригодного к массовому использованию препарата.
Около двух лет потребовалось на то, чтобы выделить чистое действующее вещество и испытать его в клинических условиях. На этом этапе к исследованиям был привлечен первооткрыватель. Флемингу, Флори и Чейну удалось успешно вылечить несколько тяжелых случаев сепсиса и пневмонии, благодаря чему пенициллин занял свое законное место в фармакологии.
В последующем была доказана его эффективность в отношении таких заболеваний, как остеомиелит, родильная горячка, газовая гангрена, стафилококковая септицемия, гонорея, сифилис и многих других инвазивных инфекций.
Уже в послевоенные годы было выяснено, что пенициллином можно лечить даже эндокардит. Эта сердечная патология ранее считалась неизлечимой и приводила к летальному исходу в 100% случаев.
Читайте далее: Список всех антибиотиков пенициллинового ряда и море данных о них
Многое о личности первооткрывателя говорит тот факт, что Флеминг категорически отказался патентовать свое открытие. Понимая всю значимость препарата для человечества, он считал обязательным сделать его доступным для всех. Кроме того, сэр Александр весьма скептически относился к собственной роли создания панацеи от инфекционных заболеваний, характеризуя её как «Миф Флеминга».
Таким образом, отвечая на вопрос о том, в каком году изобрели пенициллин, следует называть 1941г. Именно тогда был получен полноценный действенный препарат.
Параллельно разработка пенициллина велась США и России. Американскому исследователю Зельману Ваксману в 1943 удалось получить эффективный в отношении туберкулёза и чумы стрептомицин, а микробиолог Зинаида Ермольева в СССР в это же время получила крустозин (аналог, который почти в полтора раза превосходил зарубежные).
Производство антибиотиков
После научно и клинически подтверждённой эффективности антибиотиков встал закономерный вопрос об их массовом производстве. В то время шла Вторая мировая война, и фронту очень были нужны эффективные средства лечения раненых. В Великобритании возможность изготавливать лекарства отсутствовала, поэтому производство и дальнейшие исследования были организованы в США.
С 1943 года пенициллин стал выпускаться фармацевтическими компаниями в промышленных объёмах и спас миллионы людей, увеличив и среднюю продолжительность жизни. Значимость описанных событий для медицины в частности и истории в целом переоценить трудно, поскольку тот, кто открыл пенициллин, совершил настоящий прорыв.
Читайте далее: Как производят антибиотики – технологии, сырье, фильтрация и очистка
Значение пенициллина в медицине и последствия его открытия
Антибактериальное вещество плесневого гриба, выделенное Александром Флемингом и усовершенствованное Флори, Чейном и Хитли, стало основой для создания множества различных антибиотиков. Как правило, каждый препарат активен в отношении определённого вида болезнетворных бактерий и бессилен против остальных. Например, пенициллин не эффективен против палочки Коха. Тем не менее, именно разработки первооткрывателя позволили Ваксману получить стрептомицин, ставший спасением от туберкулёза.
Эйфория 50-х годов прошлого века по поводу открытия и массового производства «волшебного» средства казалась вполне оправданной. Грозные заболевания, столетиями считавшиеся смертельными, отступили, и появилась возможность существенно улучшить качество жизни. Некоторые учёные столь оптимистично смотрели в будущее, что предрекали даже скорый и неминуемый конец любым инфекционным заболеваниям. Однако даже тот, кто придумал пенициллин, предупреждал о возможных неожиданных последствиях. И как показало время, инфекции никуда не исчезли, а открытие Флеминга можно оценивать двояко.
Положительный аспект
Терапия инфекционных заболеваний с приходом в медицину пенициллина изменилась радикально. На его основе были получены препараты, эффективные против всех известных возбудителей. Теперь воспаления бактериального происхождения лечатся довольно быстро и надёжно курсом инъекций или таблеток, а прогнозы на выздоровление почти всегда благоприятны. Значительно снизилась детская смертность, увеличилась продолжительность жизни, а смерть от родильной горячки пневмонии стала редчайшим исключением. Почему же инфекции как класс никуда не исчезли, а продолжают преследовать человечество не менее активно, чем 80 лет назад?
Отрицательные последствия
На момент обнаружения пенициллина было известно много разновидностей болезнетворных бактерий. Учёным удалось создать несколько групп антибиотиков, с помощью которых можно было справиться со всеми возбудителями. Однако в ходе применения антибиотикотерапии выяснилось, что микроорганизмы под действием препаратов способны мутировать, приобретая устойчивость. Причём новые штаммы образуются в каждом поколении бактерий, сохраняя резистентность на генетическом уровне. То есть люди своими руками создали огромное количество новых «врагов», которых до изобретения пенициллина не существовало, и теперь человечество вынуждено постоянно искать новые формулы антибактериальных средств.
Читайте далее: Все о резистентности и методах определения чувствительности бактерий к антибиотикам
Выводы и перспективы
Получается, что открытие Флеминга было ненужным и даже опасным? Конечно же, нет, поскольку к таким результатам привело исключительно бездумное и бесконтрольное использование полученного «оружия» против инфекций. Тот, кто изобрел пенициллин, ещё в начале 20 века вывел три основных правила безопасного применения антибактериальных средств:
- выявление конкретного возбудителя и использование соответствующего препарата;
- достаточная для гибели возбудителя дозировка;
- полный и непрерывный курс лечения.
К сожалению, люди редко следуют этой схеме. Именно самолечение и небрежность стали причиной появления бесчисленных штаммов болезнетворных микроорганизмов и трудно поддающихся антибактериальной терапии инфекций. Само же открытие пенициллина Александром Флемингом – это великое благо для человечества, которому всё ещё нужно учиться использовать его рационально.
Читайте далее: Узнайте о современной классификации антибиотиков по группе параметров
Вам также может понравиться
lifetab.ru
История Антибиотиков - [История Медицины]
ДАНГЕР: Для ленивых внизу есть видеоролик, ну как для ленивых, там ещё есть приятная музыка на фоне и более интересное визуальное сопровождение всего того, о чем говорю, ну вы поняли, если интересно - мотайте вниз и смотрите, а если нет, то приятного чтения :)
Всего двести лет назад население земли составлял миллиард человек. Не так много не правда ли? Но и не мало. По некоторым данным, средний возраст человека того времени колебался на уровне 40 лет. Учитывая, что за последние 5 тысяч лет этот показатель менялся совсем незначительно и в принципе колебался на уровне от 30 до 40. В Древней Греции эта цифра в 680-х годах до н. э. достигала пика в 41 год. В Турции в 15 веке она составляла всего лишь 31 год, это на пять лет больше чем мне сейчас. Не хотел бы я жить в Турции 600 лет назад.
Но почему-то в Европе, начиная примерно с 60-ых годов 18-ого века эта цифра стала неуклонно расти и виной тому множество факторов: быстрый доступ к качественному питанию связанный с развитием транспорта и сельского хозяйства, реконструкция канализации, что позволило все нечистоты убрать с улиц подальше, первые пробы введения вакцинации и ещё очень много всего другого.
Но сегодня нам интересно совершенно не это. Сейчас мы рассмотрим тот самый святой грааль, который произвел настоящую революцию в медицине, который сократил смертность настолько, что за один лишь двадцатый век население земли выросло аж в 4 раза. И сейчас оно составляет уже больше 7.5 миллиардов человек!
И виной тому антибиотики! Они в рекордное время позволили человечеству избавиться от таких страшных заболеваний как чума, туберкулез, сифилис, тиф и т.д. И обычно рассказы про антибиотики сводятся к муторной болтовне о том, как открыли пенициллин и долгой не такой интересной, но несомненно важной проблеме как антибиотикорезистентность.
И нет, мы с вами здесь не для этого собрались, сегодня мы попытаемся заглянуть в самую потаенную часть истории борьбы великих умов с маленькими микроскопическими зверушками, как их называл Левенгук, потом пройдёмся по всем закоулкам историй, предпосылок, неудач и ответвлений, связанных с нелегким трудом первооткрывателей и в конце конечно же затронем такую серьезную проблему, как антибиотикорезистентность.

Началась вся эта история с одного очень честолюбивого, но упорного голландца по имени Антони Левенгук, которого все его соседи считали слегка тронутым. Он изобрел первый в мире микроскоп, смотрел в него наблюдая бактерий, постоянно о них всем рассказывал, но никому не давал даже приблизиться к своему изобретению. А учитывая, что на дворе был 17-й век, не удивительно, что его обозвали чокнутым.
Забегая вперед скажу, что в итоге его даже приняли в члены королевского общества, которое он до конца своей жизни радовал своими уникальными на то время открытиями. Шаг за шагом Левенгук открывал новый таинственный мир, который до него ещё никто не мог видеть. Сначала он рассмотрел микробов в капле дождевой воды, затем в своем рту, потом он обнаружил, что под действием температуры микробы могут погибать. Тем не менее, этот дивный микромир таил в себе не только удивительных микроскопических животных, но и большую опасность. В те времена ещё никто не знал, что микробы способны не только беззаботно покрывают все наше тело снаружи и изнутри, никто не знал, что они несут смертельную угрозу.

Пройдет ещё не меньше двухсот лет, прежде чем один молодой человек из семьи квакеров из Йоркшира по имени Джозеф Листер, вдохновившись микробной теорией Пастера, решит, что всё таки эти маленькие животные не совсем такие безобидные, и вполне могут приводить к смерти. По крайней мере, некоторые из них. И не с пустого места он это выдумал, ведь Джозеф Листер был хирургом, работал в Королевском госпитале Глазго и преподавал медицину в тамошнем университете.
Вообще, попасть в больницу в то время было делом не из простых, точнее выбраться оттуда. А вот соглашаться на операцию - это уже было самым последним на что только мог пойти пациент. Больница в те времена представляла собой жуткое, душное, темное место, источающее зловоние, как результат гангрены и сепсиса. Больных укладывали на старые грязные простыни, порой даже на простыни умерших от заражения людей. Никто не думал, что болезни могут передаваться каким либо способом, кроме как через зловонные испарения. Поэтому все боролись не с грязью, а с запахом и больше 40% пациентов перенесших ампутацию или открытый перелом, погибали от инфекций, в армии этот показатель и вовсе достигал 70%.
И Джозеф Листер знал что здесь что-то не то, он предполагал, что бактерии могут все таки убивать и они действительно это делают, эксперименты Пастера это подтверждали. Джозеф разработал первый в истории антисептик - им была карболовая кислота, которая обеззараживала рану, не давая проникнуть туда микробам которых было так много в больницах.
С августа 1867 он начал её успешно применять в своей практике и постепенно переманил других хирургов на свою сторону, на собственном примере показывая им, что микробная теория все же имеет место быть, и пора бы уже выкинуть устаревшую миазматическую теорию, что “если что-то нельзя увидеть, то этого и вовсе не существует”.
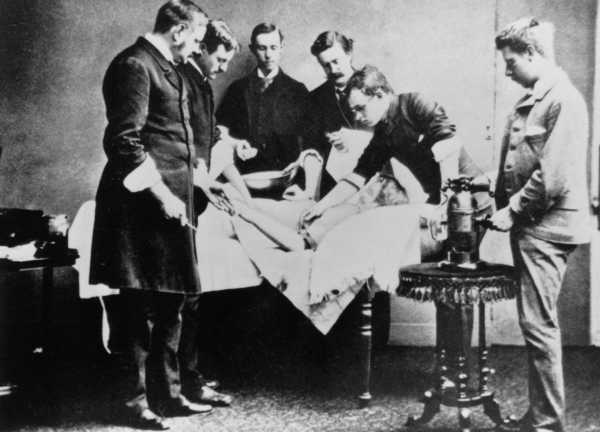
Так человечество преодолело ещё один шаг на пути к изучению и попытке обуздать злобных микробов, которые не только убивали людей в хирургических кабинетах, но и миллионами истребляли ничего не подозревающих горожан тогдашней Европы.
Следующим витком борьбе с микроскопическими убийцами было открытие Пауля Эрлиха - личности одиозной и эксцентричной. Поговаривали, что в день он выкуривал 25 сигар и часами мог философствовать в пивной. Кстати, он не был ученым, по крайней мере, на тот момент, и не имел специального образования химика или бактериолога, что не помешало ему в 1908 году получить нобелевскую премию, но уже за лечение сифилиса и его чудесный препарат №606, но об этом уже поговорим в ролике(статье) про сифилис.

Эрлих заметил, что разные анилиновые красители окрашивают только определенные ткани и клетки только определенных микроорганизмов. И он сделал вывод, что если один микроб поглощает краситель, а другой нет, то если в этот краситель подмешать чего-нибудь этакого, то его можно будет убить, теоретически.

И Эрлих начал искать способ, как этого добиться, а молекулу, способную убить другую, он называл “Волшебной Пулей”. Таким способом удалось открыть сальварсан, и ученые усердно занялись тестированием всех остальных так называемых “волшебных пуль”, стали перебирать сотни веществ тестируя их на патогенных микробах.
Этим методом в начале 30-х годов очень удачно воспользовался врач Герхард Домагк, который решил использовать краситель пронтозил красный, для того чтобы вылечить свою дочь от хронической стрептококковой инфекции, полученной в результате банального укола иголкой. Да, тогда достаточно было даже просто поцарапаться, чтобы подцепить заразу от которой можно помереть. Довольно криповые времена, согласитесь.
Сначала ученые думали, что именно окрашивание убивает бактерию, но позже выяснилось, что при расщеплении в организме этого самого красителя пронтозила красного образуется сульфаниламид.
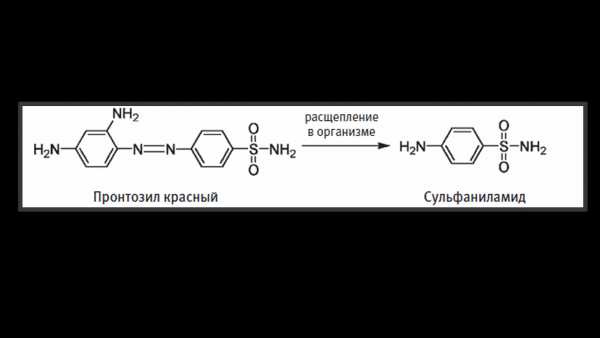
И именно он уже мешает синтезу фолиевой кислоты бактерий, что как бы является их пищей. Грубо говоря, они из-за этого голодают и умирают. Тогда-то все и смекнули, что таким способом можно лечить доселе неизлечимые болезни буквально в миг.
И вскоре сульфаниламиды и их производные стали очень широко применяться в медицине, их называли чудодейственным лекарством. У людей просто башню сносило от того, как эти препараты справлялись с фактически неизлечимыми болезнями, от которых прежде вылечиться можно было только разве что молитвой. Только в США количество смертельных случаев пневмонии сократилось на двадцать пять тысяч в год. Да и вообще в годы первой мировой от раневых инфекций умирало не меньше солдат чем от пуль врага.
В частности была очень распространена газовая гангрена, она обычно развивается в глубоких ранах, возникающих в результате разрыва бомб и снарядов, когда ткани оказываются пробитыми или раздавленными. Ее провоцирует бактерия рода Clostridium, которая является родственником бактерий, вызывающих ботулизм. Эти бактерии быстро развиваются внутри ран, где нет доступа к кислороду, и в результате её развития из раны течет гной и образуются зловонные пузырьки газа. В первую мировую такую гангрену лечили исключительно ампутацией, а если этого не получалось сделать, то раненые очень быстро погибали. Да и от ампутации в полевых условиях было тоже не намного больше пользы. Так что теперь вы можете представить, какая смертность была на полях боя от ранений, которой, кстати, не было во вторую мировую, т.к в промежуток с 1935 по 1946 гг было получено более пяти тысяч производных сульфаниламида.
Хотя сульфаниламиды и не считаются антибиотиками, потому что это вещества немикробного происхождения, это все же первые противомикробные препараты, которые снискали такую популярность в народе. Они не только сократили огромные потери солдат во вторую мировую войну, но ещё и значительно снизили смертность в США от пневмонии и способствовали снижению смертности от родильной горячки, вызываемой стрептококками.
И вот только сейчас мы подошли к тому моменту, с которого принято рассказывать людям об антибиотиках. Параллельно с открытием сульфаниламидов, сальварсаном и прочими противомикробными препаратами идет изучение того самого святого грааля, который даст человечеству на долгие годы защиту от множества микробных болезней и сведет весь страх от некогда грозных убийц в обычную бытовуху.
Встречайте пенициллины, да, те самые, которые позволили окончательно прижать злобных микроорганизмов к стенке и рассчитаться на первого-второго. Разработка пенициллина не была каким-то спонтанным мероприятием, это была довольно долгая планомерная работа по изучению плесени и её влияния на другие микроорганизмы...
Вру, это была чистейшая случайность. Ну, конкретно открытие пенициллина, а так да, плесень изучали и довольно планово, т.к люди с древности использовали её целебные свойства в лечении всяких телесных инфекций и, в принципе, в 20 веке понимали, что вот эту штуку надо бы изучать, т.к за ней будущее.

И работа по выведению антибиотиков кипела не только лишь в лаборатории, где работал Флеминг, который в 1828 году открыл противомикробные свойства плесени пенициллина, как я уже говорил, по чистой случайности. Этим вопросом занимался ещё и Зельман Ваксман, который ввел само понятие антибиотиков.

И ещё раньше в целом разные врачи использовали в своей практике плесень этого вида, тому же Листеру даже удалось вылечить одного из своих пациентов от хронического абсцесса. Систематическое же изучение плесневых грибков началось только после того, как Александер Флеминг обнаружил, что плесень рода Penicillium заражала культуру стафилококковых бактерий. Он выявил, что в присутствии плесени колонии бактерий становились прозрачными и распадались: происходил так называемый лизис. И он сложил дважды два и решил, что нужно работать в этом направлении, но не смотря на все его успехи ему не удавалось выделить достаточно пенициллина.
Понадобилось ещё 10 лет, прежде чем начало что-то получаться. Нужно было определить рабочую дозу так, чтобы она убила микроб, но не убила пациента. А это, как вы понимаете, дело нелегкое. С этим Флемингу помогли уже Говард Флори и Эрнст Чейн из Оксфордского университета.

Первые клинические испытания грубого препарата пенициллина были проведены только в 1941 году. И первый отчет звучал немного абсурдно “Лечение прошло успешно, однако пациент умер”. Все из-за того, что им тогда ещё не удалось выделить достаточное количество препарата, у них его была буквально ложка, естественно, от этого пациенту сначала стало лучше, но не надолго, т.к препарата нужно было гораздо больше. Со временем все наладилось, в начале сороковых годов производство пенициллина началось в промышленных масштабах, что было очень кстати в разгар второй мировой. За это открытие всем троим - Чейну, Флори и Флемингу сразу после окончания войны дали нобелевскую премию.
Но интересен ещё и тот факт, что работающему параллельно Ваксману практически сразу же после Чейна и Флори удалось выделить стрептомицин, точнее, это сделал его аспирант Альберт Шац, с которым они потом долго судились за право первооткрывателяю

Но все же нобелевскую премию за эти заслуги в 1952 году дали только Ваксману. И именно с этого времени и началась эра антибиотиков.
За следующие пятьдесят лет откроют десятки антибиотиков, что поможет полностью расправиться со смертоносными врагами терроризировавшими человечество и вздохнуть полной грудью не одному поколению врачей. А ещё загрязнить атмосферу, убить экологию и произвести на свет целый миллиард китайцев, но это уже мелочи, главное, что враг повержен.
Чем же примечателен антибиотик? Как он стал тем, за что все мы его так любим, и как он, собственно говоря работает?
Во-первых, антибиотик люди не придумали, а открыли, помог нам в этом естественный отбор, т.к те полезные свойства бактерий, которые мы используем в своих целях нужны им, чтобы конкурировать с другими бактериями. То бишь, у них есть свои интересы, и они их отстаивают, а приходя на очередную стрелку, чтобы отстоять свою территорию и ресурсы, микробы видят, что они здесь далеко не одни, и что все до зубов вооружены. Кто-то притащил кастет, кто-то биту, а кто-то вообще коктейль молотова. И один главарь - представитель самых успешных бактерий говорит своим подчиненным: “
“Джонни, мать твою, доставай стволы, сейчас мы покажем этим ублюдкам!”И начинается заварушка. Люди в это время смотрят в микроскоп и наблюдают, у кого же из бактерий оружие толще, и берут на карандаш тех бактерий, которые хорошо справляются уже с нашими обидчиками. Так мы научились использовать во благо природное свойство одних бактерий убивать другие, но как они это делают? Это хороший вопрос. По разному.
Некоторые антибиотики могут убивать бактерии, некоторые просто тормозят их размножение, некоторые связываются с бактериями так, что у них потом вся клеточная жизнь идет одним местом, блокируют синтез ДНК, РНК, белков, клеточной стенки и т.д. Существует целая куча препаратов, которые работают по-разному и убивают тоже разные бактерии. Людей они, как правило, не трогают, но делают это лишь потому, что мы сознательно выбираем тех, которые будут нас лечить, а не убивать, так-то людей и кипятить можно- это тоже убивает бактерий, но лучше так делать не стоит.
И вот сейчас мы подошли к тому моменту когда все вроде бы прекрасно, прошли долгий путь к синтезу, успешно лечим болезни, которые всего 100 лет назад убивали людей миллионами, но не все так просто. Тот же естественный отбор, который помог нам найти святой грааль, что нас всех вылечил, нас же теперь и убивает.
Есть такое понятие - антибиотикорезистентность. И эту штуку нельзя недооценивать, точно так же, как мы адаптируемся к внешним неблагоприятным условиям, адаптируются и наши болезни к тому, чем мы их убиваем. Получается этакая эволюция наперегонки: мы травим их одними антибиотиками, они приспосабливаются, мы разрабатываем другие, они приспосабливаются и к этим. В итоге, если мы не будем постоянно искать новые способы борьбы с резистентными микробами, мы все просрем: все достижения ученых 20-ого века - все пойдёт коту под хвост.
Это происходит по многим причинам, самым распространенным является, наверное, неумелое использование антибиотиков. Из-за их широкого распространения в середине прошлого века, они стали для нас обыденностью, у всех дома в аптечке лежит на всякий случай хотя бы тетрациклин. Но не все понимают, что антибиотиками не все можно вылечить. К примеру, грипп и простуду вы не вылечите антибиотиками, т.к они имеют вирусную природу.
Могут быть осложнения бактериального характера и при гриппе, скажете вы, но без четкого установления характера этого осложнения иногда трудно определить антибиотик, который будет лечить именно вашу болезнь. Как правило, люди видят надпись антибиотик и не вдаваясь в подробности выпивают пару таблеток, на всякий случай, хотя он может быть совершенно бесполезен в вашем случае, т.к спектр его действия приходится на другие штаммы бактерий. Или вот ещё одна очень хорошая оплошность, людям прописывает врач антибиотики и человек принимает их не до конца, а лишь до того момента, когда ему станет чуть лучше. Правильно, зачем травить свой организм лишний раз?
Таким образом он способствует появлению резистентных бактерий, которыми он рискует заразить своих близких, и когда они уже пойдут к врачу, врач им выпишет точно такое же лекарство, но оно им уже не поможет, и человек вполне может умереть. И все из-за безрассудства ваших близких, даже не той противной бабки из очереди у кабинета врача, а от самых близких вам людей.
Сам Александр Флеминг в своей нобелевской лекции в 1945 году сказал:
«Я должен сделать предупреждение. В лабораторных условиях у микроба легко вырабатывается устойчивость к пенициллину при воздействии слишком слабых, не уничтожающих его доз. То же самое может случиться и в организме. Наступят времена, когда пенициллин будет продаваться в каждой аптеке. И тогда человек, принимая его по невежеству в недостаточных дозах, не уничтожит микробы, а выработает у них устойчивость. Возьмем гипотетическую ситуацию: у мистера Икс заболевает горло. Он покупает пенициллин и, приняв слишком слабую дозу, только закаляет стрептококк. Жена мистера Икс, заразившись от мужа, заболевает пневмонией, и ее тоже лечат пенициллином. Поскольку стрептококк теперь устойчив к воздействию, лечение не срабатывает. Миссис Икс умирает. Кто виноват в ее смерти? Не кто иной, как мистер Икс, бездумным приемом пенициллина повлиявший на природу микроба»
Ещё большая проблема с антибиотиками кроется в корыстных соображениях скотоводов, которые добавляют в корм животным антибиотики для профилактики инфекций и для того, чтобы животное лучше набирало вес. Никто не знает почему животные набирают вес на антибиотиках, но такой факт есть и именно из-за того, что ученые не могут показать, как именно это происходит, возникают проблемы в регулировании всего этого дела. Это большая проблема, даже не смотря на то, что в цивилизованных странах существует проверка мяса на содержание в нём антибиотиков, есть страны которые просто забивают на эти договоренности. К примеру, в Китае массово кормили животных антибиотиками, которые во всем мире оставались как самая надежная защита на черный день, в результате чего бактерии быстро к нему приспособились и как говорится, что был антибиотик, что его не было.
Но самую большую угрозу здесь представляют все равно люди, точнее бесконтрольное распространение антибиотиков в местах с очень плохой медициной, ну или там, где людям попросту не по карману эта медицина. И для того, чтобы познакомиться с такими местами поближе, я предлагаю вам перенестись в полутора миллиардную Индию. Именно здесь, в стране, в которой бедняки не могут позволить себе дорогую медицинскую помощь, у них есть возможность свободно приобретать любые антибиотики на свое экспертное усмотрение, даже самые сильнодействующие.

И как показывают исследования, в Индии при респираторных заболеваниях и диарее, в 80% процентах случаев назначают антибиотики, хотя они при этих болезнях не работают. Однако у местного населения попросту нет денег, чтобы обратиться за качественной медицинской помощью и получить точный диагноз. В итоге мы получаем огромный простор для действий самым различным видам патогенов, которые в перспективе вырабатывают устойчивость ко многим существующим на сегодняшний день антибиотикам. И это уже не те гипотетические опасности, о которых говорил Флеминг в 45-ом году, это уже происходит.
В Индии, в этом плане, сложилась уникальная ситуация, если в Соединенных Штатах устойчивостью к воздействию распространенных антибиотиков обладают 20 % больничных инфекций, то в Индии – больше половины. И там примерно с 2006 года стали находить один тип гена под названием NDM-1, который может делать любую бактерию устойчивой к 14 классам антибиотиков, в том числе мощным внутривенным, которые назначаются как самое последнее средство, когда всё остальное не помогло. Особенность этой штуки в том, что она может передаваться от одной бактерии к другой при помощи горизонтального переноса генов, т.е бактерии даже не нужно размножаться, для того чтобы передать его с потомком. Одна бактерия приближается к другой, передает ей свою ДНК уже устойчивую ко всем видам антибиотиков и всё, и причем этой бактерии не нужно даже быть живой, к ней просто может подойти любая и завладеть её устойчивостью.
Пока этот ген в основном встречался в безопасных для жизни бактериях, но его способность дезактивировать действие практически всех видов антибиотиков и её активное распространение по миру мед-туристами, которые летают в индию за дешевой медицинской помощью, грозит нам всем очень и очень большой бедой.
Одно ясно точно: продажа антибиотиков в аптеках без рецепта и неумелое с ними обращение приведет нас ровно к тому, с чего мы и начинали 350 лет назад, к полной беспомощности перед лицом маленьких зверушек, которых мы можем увидеть лишь в микроскоп. Но справедливости ради стоит сказать, что эту гонку на выживание мы пока не проигрываем, и это вселяет надежду,
каждый день тысячи ученых усердно трудятся разрабатывая все новые и новые способы, которые помогают нам в этой гонке двигаться вперед.
Это очередной пост(видео) из цикла - [История Медицины], дальше планирую сделать ролики про самы разные болезни и способы борьбы с ними, к примеру про сифилис, эболу, ВИЧ, испанский грипп и про многое другое. Всем спасибо за внимание!
pikabu.ru
Изобретатель антибиотиков, история открытия первого препарата
Сейчас многие и не задумываются, что изобретатель антибиотиков является спасителем множества жизней. А ведь еще достаточно недавно большинство заболеваний и ран могли стать причиной очень длительного и часто безуспешного лечения. От простой пневмонии умирало 30% больных. Сейчас летальный исход возможен только в 1% случаев воспаления легких. И это стало возможно благодаря антибиотикам.
Когда же эти лекарства появились в аптеках и благодаря кому?
Первые шаги к изобретению
На данный момент широко известно, в каком веке изобрели антибиотики. Не возникает вопросов также относительно того, кто изобрел их. Однако, как и в случае с антибиотиками, мы знаем только имя человека, который максимально приблизился к открытию и сделал его. Обычно одной проблемой занимается большое количество ученых в разных странах.
Первым шагом к изобретению препарата стало открытие антибиоза – уничтожение одних микроорганизмов другими.
Врачи из Российской империи Манассеин и Полотебнов занимались изучением свойств плесени. Одним из их выводов их работы, стало утверждение о способности плесени бороться с различными бактериями. Они применяли препараты на основе плесени для лечения заболеваний кожи.
Затем русский ученый Мечников заметил способность бактерий, которые содержатся в кисломолочных продуктах, благотворно влиять на пищеварительный тракт.
Наиболее близок к открытию нового лекарства был французский врач по фамилии Дюшен. Он заметил, что арабы используют плесень для лечения ран на спинах лошадей. Взяв образцы плесени, врач проводил опыты по лечению морских свинок от кишечной инфекции и получил положительные результаты. Написанная им диссертация не получила отклика в научном сообществе того времени.
Так выглядит краткая история пути к изобретению антибиотиков. На самом деле многим древним народам было известно о способности плесени положительно влиять на лечение ран. Однако отсутствие необходимых методов и техники сделало невозможным появление чистого лекарственного средства на тот момент. Первый антибиотик смог появиться только в 20 веке.
Непосредственное открытие антибиотиков
Во многом изобретение антибиотиков было результатом случайности и стечения обстоятельств. Однако подобное может быть сказано и про многие другие открытия.
Александр Флеминг занимался изучением бактериальных инфекций. Особенно актуальной эта работа стала в период Первой Мировой войны. Развитие военной техники привело к появлению большего количества раненых. В ранах возникала инфекция, и это приводило к ампутациям и смертям. Именно Флеминг определил возбудителя заражений – стрептококк. Также он доказал, что традиционные для медицины антисептики не способны уничтожить бактериальную инфекцию полностью.
Однозначный ответ на вопрос, в каком году изобрели антибиотик, существует. Однако этому предшествовали 2 немаловажных открытия.
В 1922 году Флеминг открыл лизоцим – один из компонентов нашей слюны, который имеет способность уничтожать бактерии. Во время своих исследований ученый добавил свою слюну в чашку Петри, в которой были посеяны бактерии.
В 1928 году Флеминг посеял стафилококк в чашках Петри и оставил их на продолжительное время. По случайности в посевы попали частицы плесневого грибка. Когда через время ученый вернулся к работе с посеянными бактериями стафилококка, он обнаружил, что плесень разрослась и уничтожила бактерии. Такой эффект производила не сама плесень, а прозрачная жидкость, вырабатываемая в процессе ее жизнедеятельности. Это вещество ученый назвал в честь плесневых грибов (Penicillium) – пенициллин.
Далее ученый продолжил исследования пенициллина. Он выяснил, что вещество эффективно воздействует на бактерии, которые сейчас называются грамположительными. Однако, также он способен уничтожать возбудитель гонореи, хотя тот и относится к грамотрицательным микроорганизмам.
Исследования продолжались много лет. Но ученый не обладал необходимыми для получения чистого вещества познаниями в химии. Только выделенное чистое вещество можно было бы применять в медицинских целях. Опыты продолжались до 1940 года. В этом году исследованием пенициллина занялись ученые Флори и Чейн. Они смогли выделить вещество и получить препарат, пригодный для начала клинических исследований. Первые успешные результаты лечения человека были получены в 1941 году. Этот же год и считается датой появления антибиотиков.
История открытия антибиотиков была достаточно длинной. И только в период Второй мировой войны появилась возможность его массового производства. Флеминг был британским ученым, но производить лекарство на территории Великобритании в то время было невозможно – велись боевые действия. Поэтому первые образцы препарата были выпущены на территории Соединенных Штатов Америки. Часть лекарства использовалась для внутренних нужд страны, а другая часть отправлялась в Европу, в эпицентр боевых действий для спасения раненых солдат.
После окончания войны, в 1945 году, Флеминг, а также продолжатели его дела Говард Флори и Эрнст Чейн получили Нобелевскую премию за заслуги в области медицины и физиологии.
Как и в случае многих других открытий, ответить на вопрос «кто придумал антибиотик» сложно. Это стало результатом совместной работы многих ученых. Каждый из них внес необходимый вклад в процесс изобретения лекарства, без которого трудно представить современную медицину.
Важность этого изобретения
Трудно поспорить, что открытие пенициллина и изобретение антибиотиков – одно из важнейших событий 20 века. Его массовое производство открыло новую веху в истории медицины. Не так много лет назад обычная пневмония грозила летальным исходом. После того, как Флеминг изобрел антибиотик, многие болезни перестали быть смертным приговором.
Тесно связаны антибиотики и история Второй мировой войны. Благодаря этим препаратам удалось предотвратить множество смертей солдат. После ранений у многих из них развивались тяжелые инфекционные болезни, которые могли приводить к летальному исходу или ампутации конечностей. Новые препараты смогли существенно ускорить их лечение и минимизировать человеческие потери.
После произошедшей революции в медицине, некоторые ожидали, что бактерии могут быть уничтожены полностью и навсегда. Однако сам изобретатель современных антибиотиков знал об особенности бактерий – феноменальной способности приспосабливаться к изменяющимся условиям. На данный момент медицина имеет механизмы борьбы с микроорганизмами, но и у них есть свои способы защиты от препаратов. Поэтому полностью уничтожить их нельзя (по крайней мере сейчас), более того, они постоянно видоизменяются и появляются новые виды бактерий.
Проблема резистентности
Бактерии – первые живые организмы на планете, и на протяжении тысячелетий они выработали механизмы, благодаря которым выживают. После того, как пенициллин был открыт, стало известно о способности бактерий адаптироваться к нему, мутировать. В таком случае антибиотик становится бесполезен.
Бактерии размножаются достаточно быстро, и передают всю генетическую информацию следующей колонии. Таким образом, следующее поколение бактерии будет иметь механизм «самозащиты» от лекарства. К примеру, антибиотик метициллин был изобретен в 1960 году. Первые случаи резистентности к нему были зарегистрированы в 1962 году. На тот момент лечению не поддавалось 2% из всех случаев заболеваний, при которых назначают метициллин. К 1995 году он стал неэффективен в 22% клинических случаев, а через 20 лет – бактерии оказались резистентны в 63% случаев. Первый антибиотик был получен в 1941 году, а в 1948 – появились устойчивые бактерии. Обычно устойчивость к лекарству впервые проявляется через несколько лет после выпуска препарата на рынок. Именно поэтому регулярно появляются новые препараты.
Помимо природного механизма «самозащиты», бактерии приобретают резистентность к препаратам благодаря неверному использованию антибиотиков самими людьми. Причины, по которым эти лекарства становятся менее эффективны:
- Самоназначение антибиотиков. Многие не знают истинного назначения этих препаратов, и принимают их при простуде или небольшом недомогании. Также бывает, что врач однажды выписал один вид препарата, и теперь при болезни пациент принимает тот же самый препарат.
- Несоблюдение курса лечения. Часто пациент отменяет препарат, когда начинает чувствовать себя лучше. Но для полного уничтожения бактерий нужно принимать таблетки в течение того времени, которое указано в инструкции.
- Содержание антибиотиков в продуктах питания. Открытие антибиотиков позволило вылечить многие болезни. Сейчас эти препараты широко используются фермерами для лечения скота, и уничтожения вредителей, которые уничтожают урожай. Таким образом, в мясо и растительные культуры попадает антибиотик.
Плюсы и минусы
Можно однозначно сказать – изобретение современных антибиотиков было необходимо, и позволило спасти жизни многих людей. Однако, как и любого изобретения, у этих лекарств есть положительные и отрицательные стороны.
Положительный аспект создания антибиотических средств:
- болезни, которые ранее считались смертельными, оканчиваются летальным исходом во много раз реже;
- когда изобрели эти препараты, продолжительность жизни людей увеличилась (в некоторых странах и регионах в 2-3 раза);
- новорожденные и младенцы умирают в шесть раз реже;
- смертность женщин после родов сократилась в 8 раз;
- сократилось количество эпидемий, и количество пострадавших от них.
После того, как 1-й препарат антибиотик был открыт, стало известно и негативной стороне этого открытия. На время создания лекарства на основе пенициллина, существовали бактерии, которые к нему устойчивы. Поэтому ученым пришлось создавать несколько других видов медикаментов. Однако постепенно микроорганизмы выработали устойчивость к «агрессору». Из-за этого появилась необходимость создавать новые и новые препараты, которые будут способны уничтожать мутировавших возбудителей болезней. Таким образом, ежегодно появляются новые виды антибиотиков, и новые виды бактерий, которые к ним устойчивы. Некоторые исследователи говорят, что на данный момент примерно одна десятая возбудителей инфекционных болезней имеет устойчивость к антибактериальным препаратам.
proantibiotik.ru
Антибиотики и антибиотикорезистентность: от древности до наших дней
Согласно историческим источникам, еще много тысячелетий назад наши предки, столкнувшись с болезнями, вызываемыми микроорганизмами, боролись с ними доступными средствами. Со временем человечество начало понимать, почему те или иные используемые издревле лекарства способны воздействовать на определенные болезни, и научилось изобретать новые лекарства. Сейчас объем средств, используемых для борьбы с патогенными микроорганизмами, достиг особо крупных масштабов, по сравнению даже с недавним прошлым. Давайте рассмотрим, как на протяжении своей истории человек, порой того не подозревая, использовал антибиотики, и как, по мере накопления знаний, использует их сейчас.
Бактерии появились на нашей планете, по разным оценкам, приблизительно 3,5–4 миллиарда лет назад, задолго до эукариот [1]. Бактерии, как и все живые существа, взаимодействовали друг с другом, конкурировали и враждовали. Мы не можем точно сказать, использовали ли они уже тогда антибиотики, чтобы победить других прокариот в схватке за лучшую среду или питательные вещества. Но существуют доказательства наличия генов, кодирующих устойчивость к бета-лактаму, тетрациклину и гликопептидным антибиотикам, в ДНК бактерий, которые находились в древнем пермафросте возрастом 30 000 лет [2].
С момента, который принято считать официальным открытием антибиотиков, прошло чуть менее ста лет, но проблема создания новых антимикробных препаратов и использования уже известных при условии быстро возникающей резистентности к ним тревожит человечество не последние пятьдесят лет. Неспроста в своей Нобелевской речи первооткрыватель пенициллина Александр Флеминг предупреждал, что к использованию антибиотиков нужно подходить серьезно.
Так же, как и момент открытия антибиотиков человечеством на несколько миллиардов лет отсрочен от изначального их появления у бактерий, так и история использования человеком антибиотиков началась задолго до их официального открытия. И речь идет не о предшественниках Александра Флеминга, живших в 19 веке, а о совсем далеких временах.
Еще в Древнем Египте плесневелый хлеб использовали для дезинфекции порезов (видео 1). Хлеб с плесневыми грибками в лечебных целях применяли и в других странах и, видимо, вообще во многих древних цивилизациях. Например, в Древней Сербии, Китае и Индии для предотвращения развития инфекций его прикладывали к ранам. Судя по всему, жители этих стран независимо друг от друга пришли к выводу о целебных свойствах плесени и использовали ее для лечения ран и воспалительных процессов на коже. Древние египтяне прикладывали к гнойникам на коже головы корки плесневелого пшеничного хлеба и считали, что использование этих средств поможет умилостивить духов или богов, ответственных за болезни и страдания.
Видео 1. Причины появления плесени, ее вред и польза, а также применение в медицине и перспективы использования в будущем
Жители Древнего Египта для лечения ран использовали не только хлеб с плесенью, но и самостоятельно изготовленные мази. Есть информация о том, что примерно в 1550 г. до н.э. они готовили смесь из свиного сала и меда, которую наносили на раны и перевязывали специальной тканью. Такие мази обладали некоторым антибактериальным эффектом в том числе благодаря содержащейся в меде перекиси водорода [3], [4]. Египтяне не были первопроходцами в использовании меда — первым упоминанием о его целебных свойствах считают запись на шумерской табличке, датируемую 2100–2000 гг. до н.э., где говорится, что мед можно использовать как лекарство и мазь. И Аристотель также отмечал, что мед хорош для лечения ран [3].
В процессе исследования костей мумий древних нубийцев, живших на территории современного Судана, ученые обнаружили в них большую концентрацию тетрациклина [5]. Возраст мумий составлял примерно 2500 лет, и, скорее всего, высокие концентрации антибиотика в костях не могли появиться случайно. Даже в останках четырехлетнего ребенка его количество была очень высоко. Ученые предполагают, что эти нубийцы на протяжении длительного времени потребляли тетрациклин. Скорее всего, его источником были бактерии Streptomyces или другие актиномицеты, содержащиеся в зернах растений, из которых древние нубийцы делали пиво.
В борьбе с инфекциями люди по всему миру использовали и растения. Сложно понять, когда именно некоторые из них начинали применять, из-за отсутствия письменных или других материальных свидетельств. Некоторые растения использовали потому, что человек методом проб и ошибок узнавал об их противовоспалительных свойствах. Другие растения использовали в кулинарии, и вместе со вкусовыми свойствами они обладали и антимикробным действием.
Так обстоит дело с луком и чесноком. Эти растения с давних пор использовали в приготовлении пищи и медицине. Об антимикробных свойствах чеснока знали еще в Китае и Индии [6]. А не так давно ученые выяснили, что народная медицина не зря использовала чеснок — его экстракты угнетают Bacillus subtilis, Escherichia coli и Klebsiella pneumonia [7].
В Корее издревле для лечения желудочно-кишечных инфекций, вызываемых сальмонеллой, используют лимонник китайский Schisandra chinensis. Уже в наши дни, после проверки действия его экстракта на эту бактерию, оказалось, что лимонник действительно обладает антибактериальным действием [8]. Или, к примеру, на присутствие антибактериальных веществ проверили специи, которые широко используются по всему миру. Получилось, что душица, гвоздика, розмарин, сельдерей и шалфей угнетают такие патогенные микроорганизмы, как Staphylococcus aureus, Pseudomonas fluorescens и Listeria innocua [9]. На территории Евразии народы часто заготавливали ягоды и, естественно, использовали их в том числе и в лечении. Научные исследования подтвердили, что некоторые ягоды обладают антимикробной активностью. Фенолы, особенно эллаготанины, содержащиеся в плодах морошки и малины, ингибируют рост кишечных патогенных микроорганизмов [10].
Заболевания, вызываемые патогенными микроорганизмами, еще с давних времен использовали для нанесения противнику вреда с минимальными собственными затратами.
Существует версия, что хан Джанибек при осаде крымского города Каффы пошел на хитрость и катапультами забрасывал трупы умерших от чумы в город. Захватить Каффу так и не удалось, потому что войско хана было ослаблено. Но начавшаяся в Каффе эпидемия вместе с людьми, которые стремились поскорее покинуть город, начала распространяться по всей Европе. Некоторые ученые предполагают, что именно это событие и положило начало пандемии чумы XIV века в Западной Европе.
Использование древними хеттами туляремии считается первым упоминанием о применении биологического оружия. Они засылали в стан неприятеля больных овец, которых те забирали к себе в стада. Распространялось заболевание, которому подвержены и домашние животные (овцы, свиньи, лошади), и человек, через укусы кровососущих насекомых [11]. Проблема такого оружия в том, что оно неизбирательно. С этим столкнулись и древние хетты, которые в определенный момент вместе с захваченным скотом принесли к себе и туляремию.
Сейчас использование бактериологического оружия запрещено «Протоколом о запрещении применения на войне удушающих, ядовитых или других подобных газов и бактериологических средств» (кратко — «Женевским протоколом»), подписанным в 1925 году.
XX век
1940–1960-е годы XX века называют «золотой эрой» открытия антибиотиков. В то время, чтобы получить новое вещество, обладающее антибиотической активностью, можно было взять пробу почвы, выделить из нее микроорганизмы и изучать их. На этом же объекте исследования можно было испытывать новосинтезированные или выделенные из других микроорганизмов антибиотики. В 1980-х начала свое развитие комбинаторная химия, а в 1990-х ее методы стали использовать фармкомпании, в том числе и для поиска новых антибиотиков.
Официально, «золотая эра антибиотиков» начинается с открытия пенициллина. Это произошло в 1928 году, и первооткрывателем официально считают британского бактериолога Александра Флеминга (рис. 1). Кстати, ту самую чашку Петри, благодаря которой он сделал открытие и в дальнейшем получил Нобелевскую премию, вместе с той самой плесенью не так давно продали на аукционе за 14 тысяч долларов.
Рисунок 1. Александр Флеминг.
Поначалу открытие Флеминга не использовалось для лечения пациентов и продолжало свою жизнь исключительно за дверями лаборатории. К тому же, как сообщали современники Флеминга, он не был хорошим оратором и не мог убедить общественность в полезности и важности пенициллина. Вторым рождением этого антибиотика можно назвать его переоткрытие учеными из Великобритании Эрнстом Чейном и Говардом Флори в 1940–1941 гг.
В СССР тоже использовали пенициллин, причем если в Великобритании применяли не особенно производительный штамм, то советский микробиолог Зинаида Ермольева в 1942 году обнаружила таковой и даже сумела наладить производство антибиотика в условиях войны [14]. Наиболее активным штаммом был Penicillium crustosum, и поэтому поначалу выделенный антибиотик называли пенициллин-крустозин. Его использовали на одном из фронтов во время Великой Отечественной войны для профилактики послеоперационных осложнений и лечения ран [15].
В Европе пенициллин тоже использовали для лечения военных, причем после того, как этот антибиотик начали применять в медицине, он оставался привилегией исключительно военных [16]. Но после пожара 28 ноября 1942 года в ночном клубе Бостона пенициллин стали применять и для лечения гражданских пациентов. У всех пострадавших были ожоги разной степени сложности, и в то время такие пациенты зачастую умирали от бактериальных инфекций, вызываемых, например, стафилококками. Компания Merck & Co. отправила пенициллин в госпитали, где содержались пострадавшие при этом пожаре, и успех лечения поставил пенициллин в центр внимания общественности. К 1946 году он стал широко использоваться в клинической практике.
Доступным для общественности пенициллин оставался вплоть до середины 50-х годов XX века. Естественно, находясь в неконтролируемом доступе, этот антибиотик зачастую использовался неуместно. Есть даже примеры пациентов, которые считали, что пенициллин — чудо-средство от всех человеческих болезней, и применяли его даже для «лечения» того, что ему по природе своей не способно поддаться. Но в 1946 году в одном из американских госпиталей заметили, что 14% взятых от больных пациентов штаммов стафилококка были устойчивы к пенициллину. А в конце 1940-х этот же госпиталь сообщил, что процент резистентных штаммов вырос до 59%. Интересно заметить, что первые сведения о том, что к пенициллину возникает устойчивость, появились в 1940 году — еще до того, как антибиотик стали активно использовать [17].
До открытия в 1928 году пенициллина, были, конечно, и открытия других антибиотиков. На рубеже XIX–XX веков заметили, что голубой пигмент бактерии Bacillus pyocyaneus способен убивать множество патогенных бактерий, таких как холерный вибрион, стафилококки, стрептококки, пневмококки. Он был назван пиоционазой, но открытие не послужило основой для разработки препарата, потому что вещество было токсично и нестабильно.
Первым коммерчески доступным антибиотиком стал препарат «Пронтосил», который разработал немецкий бактериолог Герхард Домагк в 1930-х годах [18]. Есть документальные свидетельства, что первым вылеченным человеком оказалась его собственная дочь, которая долго страдала от заболевания, вызванного стрептококками. В результате лечения она выздоровела всего за несколько дней. Сульфаниламидные препараты, к которым относится и «Пронтосил», широко использовали во время Второй мировой войны страны антигитлеровской коалиции для предотвращения развития инфекций.
Вскоре после открытия пенициллина, в 1943 году, Альберт Шац, молодой сотрудник в лаборатории Зельмана Ваксмана [19], выделил из почвенной бактерии Streptomyces griseus вещество, обладающее противомикробной активностью. Этот антибиотик, названный стрептомицином, оказался активным против многих распространенных в то время инфекций, в том числе туберкулеза и чумы.
И все же, примерно до 1970-х годов никто серьезно не задумывался о развитии резистентности к антибиотикам. Затем были замечены два случая заболевания гонореей и бактериальным менингитом, когда бактерия, устойчивая к лечению пенициллином или антибиотиками пенициллинового ряда, вызывала смерть пациента. Эти события ознаменовали момент, когда с десятилетиями удачного лечения заболеваний было покончено.
Надо понимать, что бактерии — это живые системы, поэтому они изменчивы и со временем способны выработать резистентность к любому антибактериальному препарату (рис. 2). Например, к линезолиду бактерии не могли выработать устойчивость на протяжении 50 лет, но все-таки сумели приспособиться и жить в его присутствии [20]. Вероятность развития антибиотикорезистентности в одном поколении бактерий составляет 1:100 млн. К действию антибиотиков они приспосабливаются по-разному. Это может быть усиление клеточной стенки, которую, к примеру, использует Burkholderia multivorans, вызывающая пневмонию у людей с иммунодефицитами [21]. Некоторые бактерии, такие как Campylobacter jejuni, которая вызывает энтероколит, очень эффективно «выкачивают» антибиотики из клеток при помощи специализированных белковых насосов [22], и поэтому антибиотик не успевает подействовать.
Рисунок 2. Один из путей возникновения антибиотикорезистентности.Чтобы увидеть рисунок в полном размере, нажмите на него.
Первый случай возникновения метициллинустойчивого золотистого стафилококка (MRSA) зафиксировали в Великобритании в 1961 году, а в США — немного позднее, в 1968-м [23]. Про золотистого стафилококка мы чуть подробнее поговорим дальше, но в контексте скорости выработки у него резистентности стоит отметить, что в 1958 году против этой бактерии стали использовать антибиотик ванкомицин. Он был способен работать с тем штаммами, которые не поддавались воздействию метициллина. И до конца 1980-х годов считалось, что к нему резистентность должна вырабатываться дольше или вообще не вырабатываться. Однако в 1979 и 1983 годах, по прошествии всего пары десятков лет, в разных частях мира были зафиксированы случаи устойчивости и к ванкомицину [24].
Похожий тренд соблюдался и для других бактерий, а некоторые оказались способными выработать резистентность вообще за год. Но кто-то приспосабливался немного медленнее, например, в 1980-х годах только 3–5% S. pneumonia были устойчивы к пенициллину, а в 1998 году — уже 34%.
XXI век — «кризис инноваций»
За последние 20 лет многие большие фармкомпании — например, Pfizer, Eli Lilly and Company и Bristol-Myers Squibb — сократили число разработок или вообще закрыли проекты по созданию новых антибиотиков. Это можно объяснить не только тем, что стало сложнее искать новые вещества (потому что все, которые было легко найти, уже нашли), но и потому что есть другие востребованные и более прибыльные области, например, создание лекарств для лечения онкологических заболеваний или депрессии.
Тем не менее, время от времени то один, то другой коллектив ученых или компания сообщает, что они открыли новый антибиотик, и заявляет, что «вот он уж точно победит все бактерии/некоторые бактерии/определенный штамм и спасет мир». После этого зачастую ничего не происходит, и такие высказывания вызывают у общественности только скепсис. Ведь помимо тестирования антибиотика на бактериях в чашке Петри, нужно провести испытания предполагаемого вещества на животных, а затем и на людях. Это занимает много времени, таит в себе немало подводных камней, и обычно на одной из этих фаз открытие «чудесного антибиотика» сменяется закрытием.
Для того чтобы найти новые антибиотики, применяют различные методы: как классической микробиологии, так и более новые — сравнительной геномики, молекулярной генетики, комбинаторной химии, структурной биологии. Некоторые предлагают отойти от этих «привычных» методов и обратиться к знаниям, накопленным на протяжении истории человечества. Например, в одной из книг Британской библиотеки ученые заметили рецепт бальзама от глазных инфекций, и им стало интересно, на что он способен сейчас. Рецепт датировался X веком, поэтому вопрос — будет работать или нет? — был действительно интригующим. Ученые взяли именно те ингредиенты, которые были указаны, смешали в нужных пропорциях и проверили на метициллинрезистентном золотистом стафилококке (MRSA). К удивлению исследователей, более 90% бактерий были убиты этим бальзамом. Но важно заметить, что такой эффект наблюдался только при совместном использовании всех ингредиентов [25], [26].
Действительно, порой антибиотики природного происхождения работают не хуже современных, но их состав настолько сложен и зависит от многих факторов, что быть точно уверенным в каком-то определенном результате затруднительно. Также, невозможно сказать, замедляется ли скорость выработки устойчивости к ним или нет. Поэтому их не рекомендуют использовать как замену основной терапии, а как дополнение под строгим контролем врачей [20].
Проблемы резистентности — примеры болезней
Невозможно дать полную картину резистентности микроорганизмов к антибиотикам, потому как эта тема многогранна и, несмотря на несколько поутихший интерес со стороны фармкомпаний, достаточно активно исследуется. Соответственно, очень быстро появляется информация о все новых и новых случаях устойчивости к антибиотикам. Поэтому мы ограничимся лишь несколькими примерами для того, чтобы хотя бы поверхностно показать картину происходящего (рис. 3).
Рисунок 3. Временная шкала открытия некоторых антибиотиков и выработки устойчивости к ним.
Туберкулез: риск в современном мире
Туберкулез особенно распространен в Центральной Азии, Восточной Европе и России, и то, что у туберкулезных микробов (Mycobacterium tuberculosis) возникает устойчивость не только к определенным антибиотикам, но и к их комбинациям, должно вызывать тревогу.
У пациентов с ВИЧ из-за пониженного иммунитета нередко возникают оппортунистические инфекции, вызываемые микроорганизмами, которые в норме могут без вреда присутствовать в организме человека. Одной из них является туберкулез, который к тому же отмечен как основная причина смерти ВИЧ-положительных пациентов по всему миру. О распространенности туберкулеза по регионам мира можно судить из статистики — у пациентов с ВИЧ, заболевших туберкулезом, если они проживают в Восточной Европе, риск умереть в 4 раза выше, чем если бы они жили в Западной Европе или даже Латинской Америке. Конечно, стоит отметить, что на эту цифру влияет то, насколько в медицинской практике региона принято проводить тесты на восприимчивость пациентов к лекарствам. Это позволяет применять антибиотики только при необходимости.
За ситуацией с туберкулезом наблюдает и ВОЗ. В 2017 году она выпустила доклад о выживаемости при туберкулезе и его мониторинге в Европе. Существует стратегия ВОЗ по ликвидации туберкулеза, и поэтому пристальное внимание обращается на регионы с высоким риском заражения этим заболеванием.
Туберкулез унес жизни таких мыслителей прошлого, как немецкий писатель Франц Кафка и норвежский математик Н.Х. Абель. Однако это заболевание вызывает тревогу и сегодня, и при попытке взглянуть в будущее. Поэтому и на общественном, и на государственном уровнях стоит прислушиваться к стратегии ВОЗ и стараться снизить риски заражения туберкулезом.
В докладе ВОЗ подчеркнуто, что с 2000 года фиксируется меньше случаев заражения туберкулезом: в период с 2006 по 2015 годы число случаев уменьшалось на 5,4% в год, а в 2015 уменьшилось на 3,3%. Тем не менее, несмотря на такой тренд, ВОЗ призывает с вниманием относиться к проблеме антибиотикорезистентности Mycobacterium tuberculosis, и, используя методы гигиены и постоянный мониторинг населения, уменьшать число случаев инфицирования.
Устойчивая гонорея
Американское агентство Центры по контролю и профилактике заболеваний (CDC) подсчитали, что в США ежегодно фиксируется более 800 тысяч случаев заболевания гонореей, а во все мире, по оценке ВОЗ, — 78 миллионов случаев. Это инфекционное заболевание вызывается гонококком Neisseria gonorrhoeae. В проведенных исследованиях за период с 2009 по 2014 годы показано, что многие штаммы гонококка резистентны к препарату первой линии — ципрофлоксацину, а также увеличивается число устойчивых штаммов к азитромицину и препаратам группы цефалоспоринов широкого спектра действия. В большинстве стран никакие другие антибиотики, кроме цефалоспоринов, не способны воздействовать на гонококка, но уже и к ним возрастает устойчивость. Недавно выявили три случая, когда гонококк оказывался устойчивым ко всем известным препаратам, применяемым для лечения гонореи [27].
Масштабы резистентности других бактерий
Примерно 50 лет назад начали появляться штаммы золотистого стафилококка, устойчивые к антибиотику метициллину (MRSA). Инфекции, вызванные метициллинрезистентным золотистым стафилококком, ассоциированы с бóльшим количеством смертей, чем инфекции, вызванные метициллинчувствительным стафилококком (MSSA). Большинство из MRSA также устойчиво и к другим антибиотикам. В настоящее время они распространены и в Европе, и в Азии, и в обеих Америках, и в Тихоокеанском регионе [28]. Эти бактерии чаще других становятся устойчивыми к антибиотикам и в США убивают 12 тысяч людей за год [29]. Есть даже факт, что в США MRSA в год уносит больше жизней, чем ВИЧ/СПИД, болезнь Паркинсона, эмфизема легких и убийства вместе взятые [30], [31].
В период с 2005 по 2011 год стали фиксировать меньше случаев заражения MRSA как госпитальной инфекцией. Это связано с тем, что в медицинских учреждениях взяли под строгий контроль соблюдение гигиенических и санитарных норм. Но в общей популяции такой тренд, к сожалению, не сохраняется.
Энтерококки, устойчивые к действию антибиотика ванкомицина — большая беда. Они не так широко распространены на планете, по сравнению с MRSA, но в США каждый год фиксируется около 66 тысяч случаев заражения Enterococcus faecium и, реже, E. faecalis. Они являются причиной большого спектра заболеваний и особенно среди пациентов медицинских учреждений, то есть они — причина госпитальных инфекций. При заражении энтерококком около трети случаев приходится на штаммы, устойчивые к ванкомицину.
Пневмококк Streptococcus pneumoniae является причиной бактериальной пневмонии и менингита. Чаще заболевания развиваются у людей старше 65 лет. Возникновение резистентности усложняет лечение и в итоге приводит к 1,2 миллионам случаев заболевания и 7 тысячам смертей ежегодно. Пневмококк резистентен к амоксициллину и азитромицину. К менее распространенным антибиотикам он тоже выработал устойчивость, и в 30% случаев резистентен к одному или нескольким применяемым в лечении препаратам. Надо заметить, что даже если присутствует небольшой уровень устойчивости к антибиотику, это не снижает эффективность от лечения им. Использование препарата становится бесполезным в случае, если количество резистентных бактерий превышает определенный порог. Для внебольничных пневмококковых инфекций этот порог составляет 20–30% [32]. В последнее время стало происходить меньше случаев заражения пневмококком, потому что в 2010 году создали новую версию вакцины PCV13, которая действует против 13 штаммов S. pneumoniae.
- От сельскохозяйственных животных. Антибиотики специально добавляют в корм скоту — в основном, для того чтобы ускорить рост животных и предотвратить инфекции. В США до 80% всех производимых антибиотиков используют как раз в виде добавки к корму [29]. Резистентные бактерии могут перейти к человеку непосредственно на ферме, либо через плохо приготовленные и не стерилизованные продукты питания. Также, отходы жизнедеятельности животных попадают в окружающую среду, где и неметаболизированные антибиотики, и резистентные микроорганизмы могут влиять на микроорганизмы, живущие в этой среде.
- От растений. В растениеводстве широко применяют антибиотики, чтобы защитить растения от нежелательных патогенов, способных погубить весь урожай. Но если немного не рассчитать дозу используемого антибиотика, то может получиться устойчивый к нему микроорганизм. С плохо помытой и приготовленной пищей он попадает к человеку, у которого может вызывать неприятные последствия.
- От человека к человеку. Носитель антибиотикорезистентного микроорганизма может распространять этот микроорганизм и заражать других людей, например, в общественных местах и больницах (являясь потенциальной причиной появления госпитальной инфекции).
- Из окружающей среды. В среду микроорганизм попадает вышеперечисленными путями и через немытые руки и с плохо обработанной пищей вновь может оказаться у человека и стать неприятной проблемой.
Примерная схема показана на рисунке 4.
Рисунок 4. Олег и «круговорот» резистентных бактерий.Чтобы увидеть рисунок в полном размере, нажмите на него.
Пристальное внимание должно оказываться не только бактериям, которые уже развивают или развили резистентность, но и тем, которые пока не приобрели устойчивость. Потому что со временем и они могут измениться и начать вызывать более сложные формы заболеваний.
Внимание к нерезистентным бактериям можно объяснить и тем, что, даже легко поддаваясь лечению, эти бактерии играют роль в развитии инфекций у пациентов с ослабленным иммунитетом — ВИЧ-положительных, проходящих химиотерапию, недоношенных и переношенных новорожденных, у людей после операции и трансплантации [33]. И так как этих случаев происходит достаточное количество —
— то есть шанс, что со временем устойчивость появится и у тех штаммов, которые пока не вызывают опасений.
Госпитальные, или внутрибольничные, инфекции все чаще встречаются в наше время. Это те инфекции, которыми люди заражаются в больницах и других медицинских учреждениях при госпитализации и просто при посещении.
В США в 2011 году было зафиксировано более 700 тысяч заболеваний, вызываемых бактериями рода Klebsiella [34]. Это, в основном, внутрибольничные инфекции, которые приводят к довольно обширному спектру заболеваний, таких как пневмония, сепсис, раневые инфекции. Как и в случаях со многими другими бактериями, еще с 2001 года началось массовое появление антибиотикорезистентных клебсиелл.
В одной из научных работ ученые задались целью узнать, как гены устойчивости к антибиотикам распространены среди штаммов рода Klebsiella. Они обнаружили, что 15 довольно далеких штаммов экспрессировали металло-бета-лактамазу 1 (NDM-1), которая способна разрушать почти все бета-лактамные антибиотики [34]. Бóльшую силу эти факты обретают, если уточнить, что данные для этих бактерий (1777 геномов) получены в период с 2011 по 2015 годы от пациентов, которые находились в разных больницах с разными инфекциями, вызванными клебсиеллами.
- пациент принимает антибиотики без назначения врача;
- пациент не следует назначенному врачом курсу приема лекарств ;
- врач не обладает должной квалификацией;
- пациент пренебрегает дополнительными мерами профилактики (мытье рук, продуктов питания);
- пациент часто посещает медицинские учреждения, в которых повышена вероятность заразиться патогенными микроорганизмами;
- пациент проходит плановые и внеплановые процедуры или операции, после которых зачастую нужно принимать антибиотики во избежание развития инфекций;
- пациент потребляет мясную продукцию из регионов, не соблюдающих нормы по остаточному содержанию антибиотиков (например, из России или Китая);
- у пациента снижен иммунитет из-за болезней (ВИЧ, химиотерапия при онкологических заболеваниях);
- пациент проходит длительный курс лечения антибиотиками, например, при туберкулезе.
Настоящее (влияние на экономику) и будущее
Проблема резистентности бактерий к антибиотикам охватывает сразу несколько сфер человеческой жизни . В первую очередь, это, конечно, экономика. По разным подсчетам, сумма, которую тратит государство на лечение одного пациента с устойчивой к антибиотикам инфекцией, колеблется от $18 500 до $29 000. Эта цифра подсчитана для США, но, пожалуй, ее можно использовать и как средний ориентир по другим странам, чтобы понимать масштаб явления. Такая сумма уходит на одного пациента, но если подсчитать по всем, то оказывается, что суммарно к общему счету, который государство тратит за год на здравоохранение, нужно добавлять $20 000 000 000 [36]. И это помимо $35 000 000 000 социальных расходов. В 2006 году из-за двух наиболее распространенных госпитальных инфекций, в результате которых у людей развивался сепсис и пневмония, умерли 50 тысяч людей. Это обошлось системе здравоохранения США в сумму, превышающую $8 000 000 000.
Если антибиотики первой и второй линий не работают, то приходится либо увеличивать дозы в надежде на то, что они сработают, либо использовать антибиотики следующей линии. И в том, и в другом случае высока вероятность повышенной токсичности препарата и побочных действий. К тому же, большая доза или новый препарат будут, скорее всего, стоить дороже предыдущего лечения. Это влияет на сумму, которую затрачивают на лечение государство и сам пациент. А также на срок нахождения пациента в больнице или на больничном, число посещений врача и экономические потери от того, что работник не трудится. Большее количество дней на больничном — это не пустые слова. Действительно, пациента с заболеванием, вызванным резистентным микроорганизмом, в среднем приходится лечить 12,7 дней, по сравнению с 6,4 для обычной болезни [30].
Кроме причин, которые непосредственно влияют на экономику — траты на лекарства, на оплату больничных и время нахождения в больнице, — есть еще и немного завуалированные. Это те причины, которые влияют на качество жизни людей, у которых обнаружены антибиотикорезистентные инфекции. Некоторые пациенты — школьники или студенты — не могут в полной мере посещать уроки, и поэтому у них возможны отставание в учебном процессе и психологическая деморализация. У пациентов, которые проходят курсы сильных антибиотиков, из-за побочных эффектов могут развиваться хронические заболевания. Помимо самих пациентов, заболевание морально угнетает их родственников и окружение, а некоторые инфекции настолько опасны, что заболевших приходится содержать в отдельной палате, где они зачастую не могут пообщаться с близкими. Также существование госпитальных инфекций и риск ими заразиться не позволяют расслабиться при прохождении курса лечения. Согласно статистике, около 2 миллионов американцев ежегодно заражаются госпитальными инфекциями, которые в итоге уносят 99 тысяч жизней. Чаще всего это происходит из-за заражения микроорганизмами, устойчивыми к антибиотикам [30]. Важно подчеркнуть, что кроме перечисленных выше и, несомненно, важных экономических потерь, качество жизни у людей тоже сильно страдает.
Прогнозы на будущее разнятся (видео 2). Одни пессимистически указывают на то, что к 2030–2040 годам кумулятивные финансовые потери составят 100 триллионов долларов, что равняется среднегодовому убытку в 3 триллиона долларов. Для сравнения — весь годовой бюджет США лишь на 0,7 триллиона превышает эту цифру [38]. Количество смертей от заболеваний, вызванных резистентными микроорганизмами, по оценке ВОЗ, к 2030–2040 годам приблизится к 11–14 миллионам и превысит смертность от рака.
Видео 2. Лекция Мэрин Маккены на TED-2015 — What do we do when antibiotics don’t work any more?
Неутешительны и перспективы использования антибиотиков в кормах сельскохозяйственных животных (видео 3). В исследовании, опубликованном в журнале PNAS, подсчитали, что в 2010 году во всем мире в кормá было добавлено более 63 000 тонн антибиотиков [38]. И это — только по скромным оценкам. Ожидается, что к 2030 году указанная цифра возрастет на 67%, но, что должно особенно встревожить, она удвоится в Бразилии, Индии, Китае, Южной Африке и России. Понятно, что, раз объемы добавляемых антибиотиков увеличатся, то и расход средств на них тоже увеличится. Существует мнение, что цель добавления их в корм — совсем не улучшение здоровья животных, а ускорение роста. Это позволяет быстро выращивать животных, получать прибыль от продаж и снова выращивать новых. Но при возрастающей антибиотикорезистентности, придется добавлять либо бóльшие объемы антибиотика, либо создавать комбинации из них. В любом из указанных случаев, затраты фермеров и государства, которое нередко их субсидирует, на эти препараты возрастут. При этом продажи сельскохозяйственной продукции могут даже снизиться из-за смертности животных, вызванной отсутствием действенного антибиотика или побочными эффектами нового. А также из-за страха со стороны населения, которое не хочет потреблять продукцию с этим «усиленным» препаратом. Снижение продаж или повышение цены на продукцию может ставить фермеров в бóльшую зависимость от субсидий со стороны государства, заинтересованного в обеспечении населения продуктами первой необходимости, которые как раз и предоставляет фермер. Также, многие сельхозпроизводители из-за вышеуказанных причин могут оказаться на грани банкротства, а, следовательно, это приведет к тому, что на рынке останутся лишь крупные сельскохозяйственные компании. И, как следствие, возникнет монополия крупных компаний-гигантов. Такие процессы негативно отразятся на социально-экономическом положении любого государства.
Видео 3. BBC рассказывает о том, насколько может быть опасным развитие антибиотикорезистентности у сельскохозяйственных животных
По всему миру активно развиваются направления науки, связанные с определением причин генетических заболеваний и их лечения, мы с интересом наблюдаем за тем, что происходит с методами, которые помогут человечеству «избавиться от вредных мутаций и стать здоровыми», как любят упоминать поклонники методов пренатального скрининга, CRISPR-Cas9 и только начинающего развиваться метода генетической модификации эмбрионов [39–41]. Но все это может быть понапрасну, если мы окажемся неспособны противостоять заболеваниям, вызываемым резистентными микроорганизмами. Необходимы разработки, которые позволят преодолеть проблему резистентности, иначе всему миру несдобровать.
- продажа антибиотиков только по рецепту (исключительно для лечения болезней, угрожающих жизни, а не для профилактики банальных «простуд»);
- экспресс-тесты на степень устойчивости микроорганизма к антибиотикам;
- рекомендации по лечению, подтвержденные вторым мнением или искусственным интеллектом;
- дистанционное диагностирование и лечение без посещения мест скопления больных людей (в том числе мест продажи лекарств);
- проверка на наличие антибиотикорезистентных бактерий до проведения операций;
- запрет проведения косметических процедур без надлежащей проверки;
- сокращение потребления мяса и повышение его цены из-за удорожания ведения хозяйства без привычных антибиотиков;
- увеличение смертности людей в группе риска;
- увеличение смертности от туберкулеза в странах из группы риска (Россия, Индия, Китай);
- ограниченное распространение антибиотиков последнего поколения по миру для замедления развития устойчивости к ним;
- дискриминация в доступе к таким антибиотикам по финансовому статусу и по месту проживания.
Заключение
Меньше века прошло с начала масштабного использования антибиотиков. Вместе с тем, меньше века заняло у нас, чтобы результат этого достиг грандиозных масштабов . Угроза антибиотикорезистентности вышла на глобальный уровень, и было бы глупо отрицать, что именно мы своими же усилиями создали себе такого врага. Сегодня каждый из нас ощущает на себе последствия уже возникшей устойчивости и находящуюся в процессе развития устойчивость, когда получаем от врача выписанные антибиотики, принадлежащие не к первой линии, а второй или даже последней. Сейчас существуют варианты решения этой проблемы, но самих проблем — не меньше. Предпринимаемые нами действия по борьбе с быстро развивающими устойчивость бактериями напоминают гонку. Что будет дальше — покажет время.
И время, действительно, расставляет все по своим местам. Начинают появляться средства, позволяющие улучшить работу уже существующих антибиотиков, научные группы ученых (пока что ученых, но вдруг эта тенденция вновь вернется и к фармкомпаниям) без устали трудятся над созданием и проверкой новых антибиотиков. Обо всем этом можно прочитать и воспрянуть духом во второй статье цикла.
Компания Superbug Solutions UK Ltd. («Супербаг Солюшенс», Великобритания) — одна из ведущих компаний, занимающихся уникальными исследованиями и разработками решений в области создания высокоэффективных бинарных антимикробных препаратов нового поколения. В июне 2017 года «Супербаг Солюшенс» получила сертификат от крупнейшей в истории Европейского Союза программы по исследованиям и инновациям «Горизонт 2020», удостоверяющий, что технологии и разработки компании являются прорывными в истории развития исследований по расширению возможностей применения антибиотиков.
Компания Superbug Solutions Ltd. входит в состав Superbug Solutions Group, одно из структурных подразделений которой — лаборатория — является резидентом инновационного центра «Сколково».
Superbug Solutions Group — группа компаний, создающая платформу для исследований и разработки решений в сфере бинарных и прочих инновационных медицинских препаратов. Основной продукт компании — SBS Platform — это решение на базе блокчейн-технологий для фармацевтических компаний, которое включает:
- прозрачную систему финансирования производства новых инновационных лекарств (в частности, антибиотиков);
- децентрализованную систему исследований и разработки лекарств нового поколения;
- уникальную систему их производства и дистрибуции по прямой цепочке (исключающей посредников) от производителя к конечному потребителю по методике «справедливой цены».
Методика «справедливой цены» также разработана Superbug Solutions Group и основана на данных, полученных посредством скоринга информации о покупателе. Методика позволит пациентам получать необходимые редкие лекарства по мере необходимости и по доступным ценам.
Superbug Solutions Group — революционер в области фармацевтики. В ноябре 2017 группа компаний планирует проведение ICO (initial coin offering) с целью привлечения дополнительного финансирования для дальнейшего развития платформы и эволюционных решений на ее базе.
Материал предоставлен партнёром — компанией Superbug Solutions Ltd.
- В диких условиях: как жил последний всеобщий предок LUCA;
- Vanessa M. D’Costa, Christine E. King, Lindsay Kalan, Mariya Morar, Wilson W. L. Sung, et. al.. (2011). Antibiotic resistance is ancient. Nature. 477, 457-461;
- Manisha Deb Mandal, Shyamapada Mandal. (2011). Honey: its medicinal property and antibacterial activity. Asian Pacific Journal of Tropical Biomedicine. 1, 154-160;
- Sultan Ayoub Meo, Saleh Ahmad Al-Asiri, Abdul Latief Mahesar, Mohammad Javed Ansari. (2017). Role of honey in modern medicine. Saudi Journal of Biological Sciences. 24, 975-978;
- Mark L. Nelson, Andrew Dinardo, Jeffery Hochberg, George J. Armelagos. (2010). Brief communication: Mass spectroscopic characterization of tetracycline in the skeletal remains of an ancient population from Sudanese Nubia 350-550 CE. Am. J. Phys. Anthropol.. 143, 151-154;
- A. Coppi, M. Cabinian, D. Mirelman, P. Sinnis. (2006). Antimalarial Activity of Allicin, a Biologically Active Compound from Garlic Cloves. Antimicrobial Agents and Chemotherapy. 50, 1731-1737;
- Balaji Meriga, Ramgopal Mopuri, T. MuraliKrishna. (2012). Insecticidal, antimicrobial and antioxidant activities of bulb extracts of Allium sativum. Asian Pacific Journal of Tropical Medicine. 5, 391-395;
- Mi-Hyang Lee, Hyun Ae Kwon, Dong-Yeul Kwon, Hyun Park, Dong-Hwan Sohn, et. al.. (2006). Antibacterial activity of medicinal herb extracts against Salmonella. International Journal of Food Microbiology. 111, 270-275;
- Anna M Witkowska, Dara K Hickey, Mercedes Alonso-Gomez, Martin Wilkinson. (2013). Evaluation of antimicrobial activities of commercial herb and spice extracts against selected food-borne bacteria. JFR. 2, 37;
- R. Puupponen-Pimia, L. Nohynek, S. Hartmann-Schmidlin, M. Kahkonen, M. Heinonen, et. al.. (2005). Berry phenolics selectively inhibit the growth of intestinal pathogens. J Appl Microbiol. 98, 991-1000;
- Siro Igino Trevisanato. (2007). The ‘Hittite plague’, an epidemic of tularemia and the first record of biological warfare. Medical Hypotheses. 69, 1371-1374;
- Победитель бактерий;
- Эволюция наперегонки, или почему антибиотики перестают работать;
- Волкова О. (2003). Смерть обходит задворки науки. «Гамма»;
- Ермольева З.В. Биологически активные вещества. М.: «Знание», 1966. — 32 с.;
- Saswati Sengupta, Madhab K. Chattopadhyay, Hans-Peter Grossart. (2013). The multifaceted roles of antibiotics and antibiotic resistance in nature. Front. Microbiol.. 4;
- Abraham E.P. and Chain E. (1940). An enzyme from bacteria able to destroy penicillin. Nature. 3713, 837;
- Walter Sneader. (2001) History of Sulfonamides;
- Главный «почвенник» медицины: Зельман Ваксман;
- Ремиш А. (2016). Битва за выживание. Econet;
- Chih-Chia Su, Linxiang Yin, Nitin Kumar, Lei Dai, Abhijith Radhakrishnan, et. al.. (2017). Structures and transport dynamics of a Campylobacter jejuni multidrug efflux pump. Nat Commun. 8;
- Nitin Kumar, Chih-Chia Su, Tsung-Han Chou, Abhijith Radhakrishnan, Jared A. Delmar, et. al.. (2017). Crystal structures of theBurkholderia multivoranshopanoid transporter HpnN. Proc Natl Acad Sci USA. 114, 6557-6562;
- A. P. Johnson. (2011). Methicillin-resistant Staphylococcus aureus: the European landscape. Journal of Antimicrobial Chemotherapy. 66, iv43-iv48;
- G. V. Doern, K. P. Heilmann, H. K. Huynh, P. R. Rhomberg, S. L. Coffman, A. B. Brueggemann. (2001). Antimicrobial Resistance among Clinical Isolates of Streptococcus pneumoniae in the United States during 1999-2000, Including a Comparison of Resistance Rates since 1994-1995. Antimicrobial Agents and Chemotherapy. 45, 1721-1729;
- Rayner E. (2015). AncientBiotics — a medieval remedy for modern day superbugs? The University of Nottingham;
- Macdonald F. (2015). 1,000-year-old onion and garlic remedy kills antibiotic-resistant bugs. ScienceAlert;
- Керман А. (2017). ВОЗ обеспокоена неизлечимой гонореей. «XXII ВЕК»;
- Gian Maria Rossolini, Fabio Arena, Patrizia Pecile, Simona Pollini. (2014). Update on the antibiotic resistance crisis. Current Opinion in Pharmacology. 18, 56-60;
- Ventola C.L. (2015). The antibiotic resistance crisis. Part 1: causes and threats. P.T. 40, 277–283;
- Zhabiz Golkar, Omar Bagasra, Donald Gene Pace. (2014). Bacteriophage therapy: a potential solution for the antibiotic resistance crisis. J Infect Dev Ctries. 8;
- Michael Gross. (2013). Antibiotics in crisis. Current Biology. 23, R1063-R1065;
- Березняков И.Г. (2009). Приверженность к приему лекарственных средств и пути ее повышения при бактериальных инфекциях. Болезни и антибиотики. 2;
- S. Karuthu, E. A. Blumberg. (2012). Common Infections in Kidney Transplant Recipients. Clinical Journal of the American Society of Nephrology. 7, 2058-2070;
- S. Wesley Long, Randall J. Olsen, Todd N. Eagar, Stephen B. Beres, Picheng Zhao, et. al.. (2017). Population Genomic Analysis of 1,777 Extended-Spectrum Beta-Lactamase-Producing Klebsiella pneumoniae Isolates, Houston, Texas: Unexpected Abundance of Clonal Group 307 . mBio. 8, e00489-17;
- Martin J Llewelyn, Jennifer M Fitzpatrick, Elizabeth Darwin, SarahTonkin-Crine, Cliff Gorton, et. al.. (2017). The antibiotic course has had its day. BMJ. j3418;
- Margaret A. Riley, Sandra M. Robinson, Christopher M. Roy, Morgan Dennis, Vivian Liu, Robert L. Dorit. (2012). Resistance is futile: the bacteriocin model for addressing the antibiotic resistance challenge. Biochm. Soc. Trans.. 40, 1438-1442;
- Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее;
- Thomas P. Van Boeckel, Charles Brower, Marius Gilbert, Bryan T. Grenfell, Simon A. Levin, et. al.. (2015). Global trends in antimicrobial use in food animals. Proc Natl Acad Sci USA. 112, 5649-5654;
- CRISPR-эпопея и ее герои;
- Просто о сложном: CRISPR/Cas;
- От слов к делу: технологию CRISPR-Cas впервые применили для лечения онкозаболеваний.
biomolecula.ru
История первого антибиотика
Пенициллин был открыт в 1928 году. А вот в Советском Союзе люди продолжали умирать даже тогда, когда на Западе этим антибиотиком уже лечили вовсю.
Оружие против микроорганизмов
Антибиотики (от греческих слов «анти»— против и «биос» — жизнь) - вещества, избирательно подавляющие жизненные функции некоторых микроорганизмов. Первый антибиотик был случайно открыт в 1928 году английским ученым Александром Флемингом. На чашке Петри, где он выращивал для своих опытов колонию стафилококков, он обнаружил неизвестную серо-желтоватую плесень, которая уничтожила все микробы вокруг себя. Флеминг изучил загадочную плесень и вскоре выделил из нее противомикробное вещество. Он назвал его «пенициллином».
В 1939 году английские ученые Хоуард Флори и Эрнст Чейн продолжили исследования Флеминга и вскоре был налажен промышленный выпуск пенициллина. В1945 г. за заслуги перед человечеством Флеминг, Флори и Чейн были удостоены Нобелевской премии.
Панацея из плесени
В СССР долгое время закупали антибиотики за валюту по бешеным ценам и в очень ограниченном количестве, поэтому на всех их не хватало. Сталин лично поставил перед учеными задачу о разработке собственного лекарства. Для реализации этой задачи его выбор пал на знаменитого врача-микробиолога Зинаиду Виссарионовну Ермольеву. Это благодаря ей была остановлена эпидемия холеры под Сталинградом, что помогло Красной Армии выиграть Сталинградскую битву.
Много лет спустя Ермольева так вспоминала свой разговор с вождем:
«- Над чем вы сейчас работаете, товарищ Ермольева?
- Я мечтаю заняться пенициллином.
- Что еще за пенициллин?
- Это живая вода, Иосиф Виссарионович. Да-да, самая настоящая живая вода, полученная из плесени. О пенициллине стало известно двадцать лет назад, но всерьез им так никто и не занялся. По крайней мере, у нас.
- Что вы хотите?..
- Я хочу найти эту плесень и приготовить препарат. Если это удастся, мы спасем тысячи, а может быть, и миллионы жизней! Особенно мне кажется это важным сейчас, когда раненые солдаты сплошь и рядом гибнут от заражения крови, гангрены и всевозможных воспалений.
- Действуйте. Вас обеспечат всем необходимым».
Железная леди советской науки
Тому факту, что уже в декабре 1944 года пенициллин стали массово производить в нашей стране, мы обязаны именно Ермольевой - донской казачке, с отличием окончившей гимназию, а затем и женский медицинский институт в Ростове.
Первый образец советского антибиотика был получен ею из плесени, принесенной из бомбоубежища, находившегося неподалеку от лаборатории на улице Обуха. Опыты, которые проводила Ермольева на лабораторных животных, дали потрясающие результаты: буквально умирающие подопытные зверьки, которых перед этим заразили микробами, вызывающими тяжелые заболевания, буквально после одной инъекции пенициллина выздоравливали в короткий срок. Только после этого Ермольева приняла решение попробовать «живую воду» на людях, и вскоре пенициллин стали повсеместно применять в полевых госпиталях.
Таким образом, Ермольевой удалось спасти тысячи безнадежных больных. Современники отмечали, что эта удивительная женщина отличалась неженским «железным» характером, энергичностью и целеустремленностью. За успешную борьбу с инфекциями на Сталинградском фронте в конце 1942 года Ермольева была награждена орденом Ленина. А в 1943 году ей была присуждена Сталинская премия 1-й степени, которую она передала в Фонд обороны на закупку боевого самолета. Так в небе над родным Ростовом впервые появился знаменитый истребитель «Зинаида Ермольева».
За ними будущее
Всю дальнейшую жизнь Ермольева посвятила изучению антибиотиков. За это время она получила первые образцы таких современных антибиотиков, как стрептомицин, интерферон, бициллин, экмолин и дипасфен. А незадолго до своей кончины Зинаида Виссарионовна сказала в беседе с журналистами: «На определенном этапе пенициллин был самой настоящей живой водой, но жизнь, в том числе и жизнь бактерий, не стоит на месте, поэтому для победы над ними нужны новые, более совершенные лекарства. Создать их в максимально короткие сроки и дать людям – это то, чем денно и нощно занимаются мои ученики. Так что не удивляйтесь, если в один прекрасный день в больницах и на полках аптек появится новая живая вода, но только уже не из плесени, а из чего-то другого».
Ее слова оказались пророческими: сейчас во всем мире известно более ста видов антибиотиков. И все они, как и их «младший брат» пенициллин, служат здоровью людей. Антибиотики бывают широкого спектра (активные в отношении широкого спектра бактерий) и узкого спектра действия (эффективные в отношении лишь специфических групп микроорганизмов). Единых принципов присвоения антибиотикам названий долгое время не существовало. Но в 1965 году Международный комитет по номенклатуре антибиотиков рекомендовал следующие правила:
- Если известна химическая структура антибиотика, название выбирают с учётом того класса соединений, к которому он относится.
- Если структура не известна, название даётся по наименованию рода, семейства или порядка, к которому принадлежит продуцент.
- Суффикс «мицин» присваивается только антибиотикам, синтезируемым бактериями порядка Actinomycetales.
- Также в названии можно давать указание на спектр или способ действия.
med-info.ru
Открытые дважды. Как Россия не стала родиной антибиотиков?
Историю создания антибактериальных препаратов нельзя назвать длительной — официально лекарство, которое мы теперь называем антибиотиком, было разработано англичанином Александром Флемингом в начале XX столетия. Но мало кто знает, что аналогичное изобретение на 70 лет раньше было сделано в России. Почему оно не стало применяться, и кто в итоге добился признания в этой сфере, рассказывает АиФ.ru.
Когда бактерии лечат
Первым, кто предположил существование бактерий, способных избавить человечество от тяжелых болезней, был французский микробиолог и химик Луи Пастер. Он выдвинул гипотезу о своего рода иерархии у живых микроорганизмов — и о том, что одни могут быть сильнее других. В течение 40 лет ученый искал варианты спасения от тех недугов, что долгие годы считались неизлечимыми, и ставил опыты на известных ему видах микробов: выращивал, очищал, подселял друг к другу. Именно так он обнаружил, что бактерии опаснейшей сибирской язвы могли погибать под воздействием других микробов. Однако дальше этого наблюдения Пастер не продвинулся. Самое обидное, что он даже не подозревал, насколько был близок к разгадке. Ведь «защитником» человека оказалась такая привычная и знакомая многим... плесень.

Именно этот грибок, вызывающий сегодня у многих сложные эстетические чувства, стал предметом дискуссии двух русских врачей в 1860-х годах. Алексей Полотебнов и Вячеслав Манассеин спорили — является ли зеленая плесень своего рода «прародителем» для всех грибковых образований или нет? Алексей выступал за первый вариант, более того, был уверен, что от нее произошли все микроорганизмы на земле. Вячеслав же утверждал, что это не так.
От жарких словесных дебатов медики перешли к эмпирическим проверкам и начали параллельно два исследования. Манассеин, наблюдая за микроорганизмами и анализируя их рост и развитие, обнаружил, что там, где разрастается плесень... других бактерий нет. Полотебнов, проводя свои независимые испытания, выявил то же самое. Единственное — он выращивал плесень в водной среде — и по окончании эксперимента обнаружил, что вода не пожелтела, осталась чистой. Открытие новой эры. Антибиотики изменили наш мир до неузнаваемости
Ученый признал поражение в споре и... выдвинул новую гипотезу. Он решил попробовать приготовить на основе плесени бактерицидный препарат — специальную эмульсию. Полотебнов начал применять этот раствор для лечения больных — в основном для обработки ран. Результат был ошеломляющим: пациенты шли на поправку гораздо быстрее, чем раньше.
Свое открытие, а также все научные выкладки, Полотебнов не оставил в тайне — опубликовал и представил на суд общественности. Но эти поистине революционные опыты остались незамеченными — официальная наука отреагировала вяло.
О пользе открытых форточек
Стоило бы Алексею Полотебнову быть более настойчивым, а официальным медиками немного менее инертными — и Россия была бы признана родиной изобретения антибиотиков. Но в итоге развитие новой методики лечения приостановилось на 70 лет, пока за дело не взялся британец Александр Флеминг. Ученый с самой юности хотел найти средство, которое позволяло бы уничтожать болезнетворные бактерии и спасать людям жизнь. Но главное открытие своей жизни он сделал случайно.

Флеминг занимался изучением стафилококков, при этом у биолога была одна отличительная особенность — он не любил наводить порядок на рабочем столе. Чистые и грязные банки могли вперемешку стоять неделями, при этом он забывал закрывать часть из них.
Однажды ученый оставил пробирки с остатками колоний выращенных стафилококков на несколько дней без внимания. Когда же он вернулся к стеклам, то увидел, что они все заросли плесенью — скорее всего, споры залетели через открытое окно. Флеминг не стал выбрасывать испорченные образцы, а с любопытством истинного ученого поместил их под микроскоп — и был поражен. Никакого стафилококка не было, осталась лишь плесень и капли прозрачной жидкости. Медики-герои. 5 историй людей, посвятивших жизнь медицине
Флеминг стал экспериментировать с разными видами плесени, выращивая из обычной зеленой серую и черную и «подсаживая» ее к другим бактериям — результат был удивительным. Она словно «отгораживала» от себя вредоносных соседей и не позволяла им размножаться.
Он первым обратил внимание и на «влагу», которая возникает рядом с грибковой колонией, и предположил, что жидкость должна обладать буквально «убийственной силой». В результате долгих исследований ученый выяснил, что эта субстанция может уничтожать бактерии, более того, своих свойств она не теряет даже при разведении водой в 20 раз!
Найденное вещество он назвал пенициллином (от названия плесени Penicillium — лат.).
С этого времени разработка и синтез антибиотика стали основным делом жизни биолога. Его интересовало буквально все: на какой день роста, в какой среде, какой температуре грибок работает лучше всего. В результате испытаний выяснилось, что плесень, являясь крайне опасной для микроорганизмов, безвредна для животных. Первым человеком, на котором испытали действие вещества, стал ассистент Флеминга — Стюарт Греддок, который страдал от гайморита. В качестве эксперимента ему ввели в нос порцию вытяжки из плесени, после чего состояние больного улучшилось.
Результаты своих исследований Флеминг представил в 1929 году в Лондонском медицинско-научном клубе. Удивительно но, несмотря на страшные пандемии — только за 10 лет до этого «испанка» унесла жизни миллионов человек, — официальная медицина не сильно заинтересовалась открытием. Хотя Флеминг не обладал красноречием и, по отзывам современников, был «тихий, застенчивый человек» — он все же взялся за рекламу препарата в научном мире. Ученый регулярно, в течение нескольких лет печатал статьи и делал доклады, в которых упоминал о своих опытах. И в итоге, благодаря этой настойчивости коллеги-медики все же обратили внимание на новое средство.
Четыре поколения
Медицинская общественность наконец заметила препарат, но возникла новая проблема — при выделении пенициллин быстро разрушался. И только через 10 лет после обнародования открытия на помощь Флемингу пришли английские ученые Говард Флери и Эрнст Чейн. Именно они и придумали способ, как можно выделить пенициллин, чтобы тот сохранился.
Первые открытые испытания нового препарата на пациентах состоялись в 1942 году.
33-летняя молодая жена администратора Йельского университета Анна Миллер, мать троих детей, заразилась от 4-летнего сына стрептококковой ангиной и слегла. Болезнь быстро осложнилась лихорадкой, начал развивать менингит. Анна умирала, на момент доставки в главный госпиталь Нью-Джерси ей ставили диагноз стрептококковый сепсис, что в те годы было практически приговором. Сразу по прибытии Анне сделали первый укол пенициллина, и через несколько часов — еще серию инъекций. Уже за сутки температура стабилизировалась, через несколько недель лечения женщину выписали домой. Закат эпохи. Антибиотики могут уйти в прошлое?
Ученых ждала заслуженная награда — в 1945 году Флемингу, Флори и Чейну за их работу была присуждена Нобелевская премия.
Долгое время пенициллин был единственным препаратом, который спасал жизни людей при тяжелых инфекциях. Однако периодически он вызывал аллергию, не всегда был доступен. И врачи стремились разработать более современные и недорогие аналоги.
Ученые и медики выяснили, что все антибактериальные вещества можно разделить на 2 группы: бактериостатические, когда микробы остаются живы, но не могут размножаться, и бактерицидные, когда бактерии погибают и выводятся из организма. После длительного применения ученые отметили, что микробы начинают адаптироваться и привыкать к антибиотикам, и поэтому приходится менять состав препаратов. Так появились более «сильные» и качественно очищенные препараты второго и третьего поколения.
Как и пенициллин, их применяют и в настоящее время. Но при тяжелых заболеваниях уже используются высокоэффективные антибиотики 4-го поколения, большая часть из которых синтезирована искусственно. В современные лекарства добавляют компоненты, которые помогают уменьшить риск возникновения осложнений: противогрибковые, противоаллергические и так далее.
Антибиотики помогли победить страшную «моровую язву» — чуму, наводившую ужас на все страны, черную оспу, снизили смертность от пневмонии, дифтерита, менингита, сепсиса, полиомиелита. Удивительно, а ведь все началось с научных споров и пары нечищенных пробирок.
aif.ru
Кто придумал Антибиотики - Когда Изобрели?
«...и все-таки девочке становится легче. Температура падает. Уменьшается резкая бледность. Давно миновали три дня, которые я требовала у знаменитого терапевта, а Катя живет...
- И будет жить?..
- Пока я могу сказать только одно: вот уже скоро сорок лет, как я наблюдаю эту тяжелую болезнь, и впервые не узнал ее. Вы совершили чудо. Но одна ласточка не делает весны. Будущее покажет...»
Эти несколько строк из романа Вениамина Каверина «Открытая книга» рассказывают об одном из первых применений принципиально нового лекарства антибиотика. От описанного в романе времени нас отделяет совсем немного каких-нибудь 70 лет. Но в эпоху «до антибиотиков» врачи были практически бессильны против грибковых и бактериальных инфекций. И потому слово «антибиотик» звучало как «спасение».
Термин «антибиотик» (греч. anti «против» и bios «жизнь») был предложен американским микробиологом Зельманом Ваксманом в 1942 г. Но способность одних веществ природного происхождения (грибков) подавлять рост других природных веществ (бактерий) была известна уже давно.
Плесень, выращенная в лабораторных условиях.
С целебными свойствами плесневого гриба были знакомы еще древние врачи так, например, индейцы майя лечили зеленой плесенью гнойные раны. Разумеется, это было только практическое знание, никак не подкрепленное научной базой.
В конце XIX в. замечательные русские врачи терапевт Вячеслав Авксентьевич Манассеин и дерматолог Алексей Герасимович Полотебнов описали в своих трудах убийственное действие плесневых грибков на болезнетворные микроорганизмы. Полотебнов использовал эмульсию с плесневым грибком для лечения язв у больных сифилисом, что описал в книге «Патологическое значение плесени» (1873 г.). К сожалению, идеи Манассеина и Полотебнова в то время не получили широкого практического применения.
Явление антибиоза подавления и уничтожения одних микроорганизмов другими изучал и микробиолог Луи Пастер. В 1887 г. он описал антибиоз между почвенными бактериями и бактериями возбудителями сибирской язвы. Разработки Пастера получили продолжение в трудах итальянского исследователя Бартоломео Гозио: он в 1896 г. из жидкости, содержащей культуру пенициллинового грибка, выделил кристаллическое соединение микофеноловую кислоту. Она считается одним из первых лекарств с антибактериальными свойствами. Другим стала пиоционаза, полученная немецкими врачами Рудольфом Эммерихом и Оскаром Ловом в 1899 г. Пиоционаза содержала в себе бактерию Bacillus pycyoneus, подавляющую другие бактерии возбудители холеры, тифа, дифтерита.
Однако первооткрывателем антибиотиков называют английского бактериолога Александра Флеминга. Сам же Флеминг, получивший за свое открытие в 1945 г. Нобелевскую премию, всегда отводил себе роль человека, который всего лишь «обратил на пенициллин внимание людей и дал ему имя».
История открытия Флеминга широко известна, отчасти она напоминает научный анекдот поскольку в ней нашлось место для великой случайности. В 1828 г. Флеминг проводил опыты со штаммами стафилококков. В чашках с питательной средой он выращивал колонии этих бактерий. Возможно, одна из чашек была плохо вымыта, возможно, споры плесневых грибов попали в нее каким-то другим путем, но факт остается фактом: 30 сентября 1928 г. Флеминг заметил, что в чашке со стафилококками выросла плесень. Реши ученый выкинуть испорченную культуру, открытие пенициллина состоялось бы несколько позже. Но Флемингу было не до уборки, и через какое-то время, вернувшись к той самой чашке, он заметил, что плесневые грибы уничтожили колонию стафилококков. Заинтересовавшись этим явлением, Флеминг занялся выделением из плесневых грибов активного вещества, так губительно действующего на бактериальные клетки. Полученное вскоре вещество он назвал пенициллином в честь «виновника» события грибка Penicillium notatum.
А. Флеминг в лаборатории. 1945 г.
13 сентября 1929 г. на заседании Медицинского исследовательского клуба при Лондонском университете Александр Флеминг сделал доклад о своем открытии. Он честно указал на недочеты пенициллина, главным из которых была его нестойкость его нельзя было хранить долгое время, он разрушался и терял свои свойства. Кроме того, препарат был «грязным», с многочисленными белковыми примесями, и существовал он только в слабой концентрации. Это осложняло возможное применение пенициллина в медицинской практике: чтобы достичь нужного эффекта, его приходилось бы вводить в больших объемах; это, а также наличие примесей делало препарат довольно опасным для больного.
Над тем, чтобы выделить пенициллин в пригодном для использования виде и тем самым получить эффективнейшее лекарство, стали работать британские биохимики и фармакологи Говард Флори и Эрнст Чейн. Флеминг, которому так и не удалось создать стабильную форму пенициллина, к тому времени охладел к своему открытию. Флори же и Чейн продолжали упорно работать; вспоминая то время, Флори писал: «...мы работали над пенициллином с утра до вечера. Засыпали с мыслью о пенициллине, и единственным нашим желанием было разгадать его тайну».
Начиналась Вторая мировая война, Лондон и окрестности бомбила немецкая авиация, но у ученых, трудившихся в лабораториях Оксфордского университета, был повод для радости: в мае 1940 г. умиравшие белые мыши, которых заразили стрептококками, были вылечены новым препаратом.
Э. Чейн.
Г. Флори.
Однако для полного триумфа пенициллин нужно было проверить на человеке. Осенью 1940 г. такой случай представился: в одну из клиник Оксфорда привезли мужчину, который умирал от заражения, вызванного золотистым стафилококком. Все началось с маленькой ранки в углу рта: она нагноилась и не заживала, несмотря на лечение. Потом инфекция распространилась на кожные покровы лица, рук, а главное поразила легкое. Пациент погибал, спасти его не представлялось возможным никакими доступными средствами, и потому врачи отважились сделать ему инъекцию пенициллина. Препарат подействовал невероятным образом, больной быстро пошел на поправку, однако кристаллов пенициллина, который в то время получали только в лабораторных условиях, очень медленно и в небольших количествах, не хватило для полного излечения... Главной проблемой ученых стало то, что у Великобритании во время войны не было материальных ресурсов для налаживания производства пенициллина.
Зато такими ресурсами обладала другая держава Соединенные Штаты Америки, куда и поехал за коммерческой поддержкой Говард Флори. Но нельзя упрекать американцев в том, что они взяли готовую идею. В США в то время также велись исследования: ведущие микробиологи во главе с Зельманом Ваксманом стремились выделить чистую и стабильную форму спасительного лекарства. Ваксман начинал свои исследования с того же, что когда-то интересовало и Луи Пастера: с антагонизма почвенных бактерий и палочки туберкулеза. В 1943 г. усилия Ваксмана и его группы увенчались успехом: был выделен антибиотик стрептомицин, активный против возбудителей чумы и туберкулеза.
З. Ваксман в лаборатории. 1953 г.
Первое успешное испытание на человеке британский пенициллин прошел именно в США. Это случилось в марте 1942 г. Анна Миллер, пациентка госпиталя в Нью-Хейвене (Коннектикут), уже 11 дней лежала с высокой температурой. Женщина умирала от стрептококкового сепсиса. Но счастливый случай, вечный спутник открытий! в соседней палате лечился друг Говарда Флори. Узнав об умирающей пациентке, он предложил врачам использовать последний шанс: неведомый пенициллин. Уже на следующий после введения препарата день температура у Анны снизилась. И в мае 1942 г. она вышла из больницы полностью здоровой. А в 1990 г. Анне Миллер исполнилось 82 года, и в ее честь, а также в честь первого пенициллинового чуда устроили торжества в Смитсонианском музее естественных наук в Вашингтоне.
Советские ученые в то время находились в вынужденной интеллектуальной изоляции в 1930-1940-х годах изучение иностранных журналов, а уж тем более активное общение с коллегами из-за рубежа было опасным и, следовательно, почти невозможным. Поэтому советская микробиология и фармакология развивались самостоятельно, но при этом чрезвычайно успешно. Честь открытия советского пенициллина крустозина (по названию грибка Penicillium crustosum) принадлежит микробиологу Зинаиде Васильевне Ермольевой. Она же стояла у истоков организации промышленного производства крустозина, и это было сделано в самое необходимое для того время: в разгар Великой Отечественной войны. Тысячи раненых были спасены от послеоперационных осложнений и раневых инфекций благодаря пенициллину-крустозину. Интересно, что, когда в 1944 г. в Москву с группой ученых приехал Говард Флори и предложил провести сравнительные испытания пенициллина и советского крустозина, крустозин оказался эффективнее!
Пенициллин, выпущенный фирмой Glaxo. 1950 г.
Плесневый грибок под микроскопом.
За пенициллином, стрептомицином и крустозином последовали другие антибиотики. Но «антибиотиковая эйфория» довольно быстро сменилась осторожностью. Выяснилось, что возбудители инфекций «обучаемы» многие штаммы выработали устойчивость к антибиотикам. И вот уже много лет микробиологи соревнуются с бактериями кто приспособится быстрее: появляются новые антибиотики, но появляются и устойчивые к ним штаммы микроорганизмов. Существуют и бактерии, устойчивые не к одному, а сразу к нескольким видам антибиотиков.
Однако будущее показало «первые ласточки», такие как пенициллин, крустозин, стрептомицин, были предвестниками подлинной революции в медицине. Победа над бактериями освободила человечество от множества угроз. Увы, человеческая память коротка, и благоговение перед чудом проходит слишком быстро, но это ни в коей мере не умаляет величия открытий, и в частности открытия антибиотиков.
Читаем инструкции
По мнению врачей, распространенное мнение о бесполезности или даже вредности антибиотиков вызвано тем, что практически в половине случаев эти лекарства принимаются без рекомендации врача и не по показаниям. Например, ими пытаются лечить вирусные инфекции, тот же грипп, хотя антибиотики неактивны против вирусов.
Лаборатория НИИ по изысканию новых антибиотиков им. Г. Ф. Гаузе.
altpp.ru