Лечение суставов - артроз, артрит, остеохондроз и многое другое
Фиброзно кортикальный дефект бедренной кости
Фиброзный кортикальный дефект бедренной кости у детей: причины развития, диагностика, лечение и прогноз
Фиброзный кортикальный дефект бедренной кости – опухолеподобное поражение, преимущественно солитарное, которое встречается у 30-40% детей в возрасте от 4 до 8 лет и в подавляющем большинстве случаев не требует медицинского вмешательства. Патология развивается и протекает абсолютно бессимптомно и обычно выявляется случайно при проведении рентгенологического обследования костей таза и нижних конечностей. По своим гистологическим показателям фиброзный кортикальный дефект сходен с неоссифицируемой фибромой.
Причины возникновения дефекта
Причины образования патологии на сегодняшний день остаются не до конца изученными. Выявлена некоторая связь с генетически обусловленными системными заболеваниями соединительной ткани, в частности, крупные очаги поражения часто сопутствуют нейрофиброматозу I типа, фиброзной дисплазии, синдрому Яффе-Кампаначчи. Также отдельные исследования выявляют связь развития кортикального фиброзного дефекта с гипофосфатемическим витамин Д-резистентным рахитом.
В большинстве случаев этиология заболевания остается неясной. Патология выявляется случайно при рентгенологическом обследовании. Дефект нельзя отнести к редким: согласно статистике, у 30-40% детей в возрасте от 3 до 10 лет выявляются фиброзные очаги в метафизе и диафизе большеберцовой кости. Мальчики подвержены заболеванию вдвое чаще, чем девочки. У взрослых после закрытия ростковых зон костей фиброзный дефект не развивается. Как правило, к 13-14 годам наблюдается ремиссия патологии, и очаги фиброзной ткани замещаются нормальной костной тканью.
Случаев озлокачествления фиброзных новообразований в медицинской литературе не описано.
Клиническая картина
Фиброзный кортикальный дефект обнаруживается чаще всего в метафизе и диафизе большеберцовых костей, в местах прикрепления активных мышц, и представляет собой опухолеподобное очаговое перерождение тканей. Очаги представлены волокнистой фиброзной тканью с включениями гигантских клеток, а в некоторых случаях – рассеянных в фиброзной ткани веретенообразных и ксантомных клеток: нагруженных холестериновым эфиром макрофагов, перерожденных моноцитов. Также внутри фиброзных очагов могут быть обнаружены лимфоциты и плазменные клетки как следы воспалительной реакции.
Очаги чаще всего возникают первично на периостальной поверхности, с течением времени распространяются интра- и субкортикально. В редких случаях новообразование заполняет весь поперечник кости. Если очаги имеют склонность к быстрому росту и распространению, заболевание классифицируют как неоссифицирующую фиброму и причисляют к доброкачественным новообразованиям, подлежащим оперативному лечению.
Отмечались ситуации, когда у пациента в кости одной конечности наблюдался фиброзный кортикальный дефект, а в другой – неоссифицирующая фиброма, что позволяет высказать предположение об общей природе их возникновения. При дифференциации фиброзного кортикального дефекта от неоссифицирующей фибромы принимают во внимание степень вовлечения в патологию костномозгового канала: ФКД не затрагивает его, а неоссифицируущая фиброма имеет тенденцию к прорастанию внутрь канала.
В отличие от кортикального дефекта, не выявляемого при прощупывании, фиброма может проявлять себя как припухлость плотной консистенции, неподвижная, не спаянная с кожей, слегка болезненная при пальпации.
При наличии фиброзного дефекта большеберцовой кости и при неоссифицируемой фиброме общее состояние больного остается удовлетворительным. Клинические анализы крови не позволяют выявить никаких характерных особенностей данных состояний.
Стоит отметить, что в медицинских кругах нет единого мнения о дифференциации ФКД и неоссифицирующей фибромы. Ряд специалистов считают их двумя разновидностями течения одной патологии, другие относят фиброму к опухолевым заболеваниям костной ткани, а ФКД не патологией, а дефектом или особенностью развития и роста костной ткани. Существует также мнение, что ФКД и неоссифицирующая фиброма являются разными стадиями течения одного заболевания.
Патология развивается бессимптомно и не сопровождается болевыми ощущениями или нарушениями подвижности конечностей. Однако в случаях масштабного замещения костной ткани фиброзной существенно снижается прочность кости, что может привести к патологическим переломам.
Диагностика кортикального дефекта
На рентгенологическом снимке обнаруживаются светлые очаги с четко очерченными границами склерозированной ткани, также наблюдается вздутие кортикального слоя. В случае неоссифицирующей фибромы в патологический процесс включен костномозговой канал.
Сцинтография при диагностике кортикального дефекта в большинстве случаев оказывается неэффективной и не позволяет выявить патологию. В отдельных случаях наблюдаются очаги умеренного поглощения и умеренной гиперемии. При обнаружении выраженного поглощения и гиперемии можно заподозрить перелом.
Патологию следует дифференцировать от других опухолевых образований костной ткани.
- Доброкачественная фиброзная гистоцитома отличается от фиброзного кортикального дефекта тем, что на рентгенографическом снимке не выявляется. Также фиброзная гистоцитома может вызывать болезненные ощущения.
- Фиброзная дисплазия имеет везикулярную форму, развивается от центра кости.
- Периостальный десмоид выявляется в значительно более позднем возрасте – от 12 до 20 лет.
Процесс заживления очагов фиброзной ткани на рентгенографическом снимке следует отличать от процесса злокачественной резорбции тканей.
Лечение патологии
В большинстве случаев при выявлении патологии выбирается выжидательная тактика. Назначаются регулярные обследования для отслеживания динамики роста новообразований. Проведение биопсии при фиброзном кортикальном дефекте не рекомендуется.
В том случае, если очаг занимает более 50% поперечного сечения кости и возникает угроза спонтанного перелома, проводится хирургическая операция. Путём кюретажа (выскабливания) фиброзная ткань удаляется и замещается ауто- или аллотрансплантатом.
Прогноз
В большинстве случаев прогноз заболевания благоприятный даже при отсутствии какого-либо лечения. Фиброзный кортикальный дефект бедренной кости у детей имеет тенденцию к самопроизвольному исчезновению в 100% случаев — очаги замещаются здоровой костной тканью.
В исключительно редких случаях отмечались рецидивы заболевания с повторным формированием новых фиброзных очагов на месте старых.
Неоссифицируемая фиброма также имеет положительный прогноз, как правило, после операции остеокоррекции формирование очагов отмечается в редких случаях. Функция конечности полностью сохраняется, ортопедических нарушений ни у одного из прооперированных пациентов выявлено не было: оси, длина и геометрия костей остаются сохранными.
nogostop.ru
Кортикальный дефект бедренной кости: симптомы, лечение и прогноз
Клинические проявления у детей и подростков с метафизарными фиброзными дефектами и неоссифицирующимися фибромами не являются па-тогномоничными. Из литературных источников (Квашнина В.И., 1963; Бекзадян Г.Р., Талантов В.А., 1967; Campbell C.J., Harkess J., 1957; Phelan J.T., 1964; Bullough P.G., Walley J., 1965; Ochsenschlager A., 1967; Mallet J.F., Ri-gault P., Padovani J.P. et al., 1980; Freyschmidt J., Saure D., Dammenhain S., 1981; Zieger M., Hauke H., 1986; Campanacci M., 1990) следует, что в большинстве случаев патологический процесс протекает бессимптомно и выявляется как случайная находка при рентгенографии скелета, выполненной по поводу травмы конечности или определённой ортопедической патологии (плоскостопие, болезнь Осгуда-Шлаттера, болезнь Кёнига). Некоторые пациенты отмечают повышенную утомляемость и чувство «дискомфорта» в нижних конечностях после длительной физической нагрузки, что служит поводом к рентгенологическому исследованию соответствующего отдела опорно-двигательного аппарата. Крупные очаги поражения чаще всего выявляются на фоне патологических переломов (Марин И.М., 1991; Scaglietti О., Stringa G., 1961; Bullough P.G., Walley J., 1965; Mallet J.F., Rigault P., Padovani J.P. et al., 1980; Arata M.A., Peterson H.A., Dahlin D.C., 1981; Baschang A., Laer
L., 1991; Сатрапа L., 1993; Hoeffel C, Panuel M, Plenat F. et al., 1999), частота которых при неоссифицирующихся фибромах достигает 40,7% (Батраков С.Ю., 2002). Подчёркивается, что в этих случаях консолидация костных фрагментов происходит в обычные сроки, соответствующие таковым при переломах травматического генеза (Cunningham J.B., Ackerman L.V., 1956; Arata М.А., Peterson H.A., Dahlin D.C., 1981; Blau R.A., Zwick D.L., Westphal R.A., 1988). Хотя, по сообщению M.B. Волкова (1989), подобные патологические переломы срастаются плохо и требуют «очень длительной иммобилизации». Автор считал, что у детей грудного возраста «они являются началом развития врождённого ложного сустава». В единичных публикациях, посвященных преимущественно множественным поражениям скелета, сообщается о возможных вторичных деформациях и укорочении поражённого неоссифи-цирующейся фибромой сегмента конечности (Campanacci М., Laus М., Bori-ani S., 1983; Blau R.A., Zwick D.L., Westphal R.A., 1988; Al-Rikabi A.C., Ramaswamy J.C., Bhat V.V., 2005).
Из дополнительных методов исследования в литературе наиболее полно освещен рентгенологический (Hatcher С.Н., 1945; Caffey J., 1955; Devlin J.A., Bowman H.E., Mitchell C.L., 1955; Cunningham J.B., Ackerman L.V., 1956; Maudsley R.H., Stansfeld A.G., 1956; Compere C.L., Coleman S.S., 1957; Phelan J.T., 1964; Bullough P.G., Walley J., 1965; Freyschmidt J., Saure D., Dammenhain S., 1981). Сообщается, что костные очаги в трубчатых костях располагаются эксцентрично, имеют неправильную округлую или овальную форму, чёткие полициклические склерозированные границы и характерную ячеисто-трабекулярную внутреннюю структуру. По образному выражению немецких авторов (Freyschmidt J., Ostertag Н., Saure D., 1981), участок поражения имеет вид «грозди винограда». Наибольший размер очага чаще всего ориентирован соответственно продольной оси трубчатой кости и в среднем составляет 3,0-5,0 см. Нередко указывается на выпячивание смежного с патологическим
-25-очагом участка истончённого кортикального слоя кости, а в случае микроперелома – на появление периостальной реакции (Campanacci М., 1990; Matsuo М., Ehara S., Tamakawa Y. et al., 1997). Спонтанная оссификация костных очагов характеризовалась появлением рентгенологически более плотных участков (так называемый «пятнистый остеосклероз»), постепенно выполнявших всю зону поражения (Бекзадян Г.Р., Талантов В.А., 1967; Caffey J., 1955; Meffert О., Рорре Н., 1973; Freyschmidt J., Saure D., Dammenhain S., 1981). Последующий процесс ремоделирования сопровождался практически полным восстановлением структуры костной ткани. Согласно литературным данным, сроки «самозаживления» значительно варьировали, а продолжительность существования очагов поражения с момента их выявления составляла от одного года до одиннадцати лет и более (Квашнина В.И., 1963; Sontag L.W., Pyle S.I., 1941; Ponseti I.V., Friedman В., 1949; Caffey J., 1955; Selby S., 1961; Ritschl P., Karnel F., 1986). Средние сроки персистенции костных очагов по L.W. Sontag и S.I. Pyle (1941) составили 2 года 4 месяца, по J. Caffey (1955) – 4 года 4 месяца для мальчиков и 2 года 1 месяц для девочек, по S. Selby (1961) – 3 года 6 месяцев.
Большинство исследователей считает, что характерная рентгенсемиоти-ка метафизарных фиброзных дефектов и неоссифицирующихся фибром позволяет с большой долей уверенности распознать патологический процесс (Егоров А.С., 1975; Cunningham J.B., Ackerman L.V., 1956; Gordon I.R.S., 1964; Ochsenschlager A., 1967; Skrede 0., 1970; Luders С J., 1971; Meffert O., Poppe H., 1973; Garlipp M., 1976; Makek M., 1980; Mallet J.F., Rigault P., Pado-vani J.P. et al., 1980; Gong Y., 1989; Fechner R.E., Mills S.E., 1993; Fletcher CD., Unni K.K., Mertens F., 2002). Тем не менее, в отдельных публикациях содержатся сведения, указывающие на возможную вариабельность течения патологического процесса и связанные с этим трудности дифференциальной диагностики (Caffey J., 1955; Bullough P.G., Walley J., 1965; Klumper A., 1977; Freyschmidt J., Saure D., Dammenhain S., 1981; Zieger M., Hauke H., 1986; Ma -26 tsuo M., Ehara S., Tamakawa Y. et al., 1997), а работ, в которых данный материал был бы систематизирован, в литературе не представлено.
Публикации, посвященные использованию метода компьютерной томографии при метафизарных фиброзных дефектах и неоссифицирующихся фибромах, немногочисленны и сводятся, в основном, к описанию отдельных клинических случаев (Снетков А.И., Берченко Г.Н., Морозов А.К. и др., 2002; Рёгё P., Adolphe J., Raul P. et al., 1984). Сведения о диагностических возможностях данного метода и о его информативности при интерпретации характера изменений в очаге поражения и окружающих костных структурах до настоящего времени не получили достаточного освещения в специализированной литературе.
В единичных сообщениях, относящихся к метафизарным фиброзным дефектам и неоссифицирующимся фибромам, представлены возможности радиоизотопного метода исследования в диагностически сложных ситуациях (Brenner R.J., Hattner R.S., Lilien D.L., 1979; Рёгё P., Adolphe J., Raul P. et al., 1984; Hod N., Levi Y., Fire G. et al., 2007). Однако, систематизированных количественных данных, основанных на обследовании статистически значимой группы пациентов и отражающих степень фиксации радиофармпрепарата в различные фазы исследования, в доступных научных публикациях не содержится.
Результаты компьютерно-томографического исследования
Определение относительной плотности содержимого очагов поражения показало, что значения данного параметра напрямую зависели от анализируемого участка аксиального среза. При обработке данных компьютерно-томографического исследования подтверждался мягкотканный характер основного субстрата патологического очага (рис. 19, 21), а средняя величина показателя относительной плотности ткани при метафизарных фиброзных дефектах и неоссифицирующихся фибромах составила (М+т) 64,8+2,1 ед. HU, при среднем квадратическом отклонении (ст) ± 9,5. Обнаружение участков с отрицательным значением относительной плотности являлось подтверждением процесса «липидизации» патологической ткани, обусловленного депонированием в ней нейтральных жиров (рис. 21). При спонтанной осси-фикации выявлялись зоны повышенной плотности, по значениям равной или превышающей плотность губчатой и компактной кости (рис. 19). Данные компьютерно-томографического исследования позволили установить, что наиболее выраженные признаки реактивного костеобразования отмечались на тех участках, где патологическая ткань граничила непосредственно с эн-достальной поверхностью компактной кости (рис. 18, 19).
Таким образом, компьютерная томография позволяет получить объективные данные как о характере расположения и истинных размерах метафизарных фиброзных дефектов и неоссифицирующихся фибром, так и о состоянии смежных с патологическим очагом отделов кортикального слоя кости. Результаты компьютерно-томографического исследования служат подтверждением единства происхождения метафизарных фиброзных дефектов и неоссифицирующихся фибром и совместно с другими диагностическими методами должны учитываться при выборе лечебной тактики в прогностически неясных случаях.
Основной целью радионуклидного исследования было изучение состояния регионарного кровообращения поражённой конечности и функциональной активности костной ткани в проекции расположения патологического очага. При этом неотъемлемой составляющей метода являлась регистрация количественных показателей интенсивности кровотока (так называемой «гиперемии») в фазу перфузии (КОП – коэффициент относительной перфузии) и фиксации радиофармпрепарата (РФП) в фазу остеосцинтиграфии (КОН – коэффициент относительного накопления), на основании которых проводился сравнительный анализ с данными рентгенологического и компьютерно-томографического исследований.
Радионуклидное исследование проведено 39 пациентам, из них 25 (64,1%) – с метафизарными фиброзными дефектами, а 14 (35,9%) – с неоссифицирующимися фибромами.
С учётом вычисленных показателей коэффициентов относительной перфузии (КОП) и относительного накопления (КОН) радиофармпрепарата (РФП) были выделены три группы пациентов с метафизарными фиброзными дефектами и неоссифицирующимися фибромами скелета. Сведения о них представлены в таблице 12.
Из таблицы видно, что в первую группу вошло 8 детей (20,5%) без каких-либо изменений регионарного кровообращения и функциональной активности костной ткани в проекции расположения патологического очага (КОП и КОН составили 100,0%, что соответствовало норме). Во вторую группу было включено 10 обследованных (25,6%) с отсутствием локальных очагов гиперемии в фазу перфузии (КОП – 100,0%), но с гиперфиксацией радиофармпрепарата (РФП) в проекции очага поражения в костную фазу исследования (КОН – 149,2 ± 7,6%). Третью группу составил 21 пациент (53,9%), у которых зафиксированы изменения как со стороны регионарного кровообращения поражённой конечности (КОП – 153,9 ± 9,7%), так и со стороны функциональной активности костной ткани в проекции расположения патологического очага (КОН – 206,3 ± 17,3%).
При сравнительном анализе прослеживалось соответствие между результатами сцинтиграфии, рентгенографии и компьютерной томографии. Так, у всех детей первой группы (8 наблюдений) по данным рентгенографии, компьютерной томографии и сцинтиграфии имели место метафизарные фиброзные дефекты без признаков спонтанной оссификации и резорбции смежных отделов кости («неактивные» костные очаги) (рис. 22). Вторая группа была представлена детьми как с метафизарными фиброзными дефектами (7 случаев – 70%), так и с неоссифицирующимися фибромами (3 случая – 30%). На рентгенограммах и компьютерных томограммах определялись признаки спонтанной оссификации костных очагов, а средний показатель фиксации радиофармпрепарата (РФП) в фазу остеосцинтиграфии (КОН – 149,2 ± 7,6%) соответствовал процессу вялотекущего костеобразования (рис. 23 и 24). В третьей группе распределение пациентов было следующим: 10 (47,6%) – с метафизарными фиброзными дефектами, 11 (52,4%) – с неоссифицирующимися фибромами. Данные рентгенографии и компьютерной томографии в подгруппе пациентов с метафизарными фиброзными дефектами являлись отражением как оссификации (4 случая – 40%) (рис. 25), так и продолжающегося роста патологических очагов (6 случаев – 60%) (рис. 26), а наличие локальных участков гиперемии в I фазу и гиперфиксации радиофармпрепарата (РФП) во II фазу радионуклидного исследования свидетельствовало, соответственно, либо об активно протекающих процессах остеогенеза и ремоделиро-вания костной ткани, либо о перифокальном остеолизе. Аналогичные выводы были сделаны и в подгруппе больных с неоссифицирующимися фибромами, подтверждением чему являлись результаты прицельного сравнительного анализа данных рентгенографии, компьютерной томографии и сцинтигра-фии.
Показания к оперативному лечению и виды хирургических вмешательств
Лечение пациентов с метафизарными фиброзными дефектами и неосси-фицирующимися фибромами осуществлялось по двум направлениям: консервативному и оперативному. Выбор лечебной тактики определялся результатами комплексного обследования и зависел как от первоначальных размеров костного очага, так и от динамики течения патологического процесса. Консервативное лечение проведено 107, а хирургическое – 51 пациенту.
Консервативное лечение было показано: 1. Пациентам с метафизарными фиброзными дефектами: – подвергающимися спонтанной оссификации (пациенты I группы); – без признаков оссификации и остеолиза (пациенты II группы); – с признаками остеолиза на фоне продолжающегося роста патологического очага (пациенты III группы). 2. Пациентам с неоссифицирующимися фибромами, подвергающимися спонтанной оссификации, при размерах очага, не превышающих поло вину поперечника трубчатой кости (пациенты IV группы). Таким образом, выбор консервативной тактики лечения определялся, в первую очередь, отсутствием признаков остеолиза и роста патологической ткани, а при их наличии – размерами костных очагов и сохраняющимися удовлетворительными прочностными характеристиками смежных отделов компактного вещества трубчатой кости. Учитывая тот факт, что у большинства пациентов очаги поражения располагались в длинных трубчатых костях нижних конечностей, основу консервативного лечения составляло ограничение статических и динамических физических нагрузок на ноги. В связи с этим дети освобождались от занятий физкультурой в основной группе и посещения спортивных секций. Рекомендовались адекватные по нагрузке занятия лечебной физкультурой и плаванием. Соблюдая принцип онкологической настороженности, были противопоказаны физиотерапевтические и тепловые процедуры, а также массаж соответствующей конечности. Динамическое наблюдение заключалось в проведении контрольных осмотров пациента и рентгенографии поражённого сегмента конечности, а при необходимости – компьютерной томографии и радионуклидного исследования. Для пациентов I (71 наблюдение), II (27 наблюдений), IV (12 наблюдений) групп с «неактивными» и подвергающимися спонтанной оссификации метафизарными фиброзными дефектами и неоссифицирующимися фибромами контрольные осмотры осуществлялись с периодичностью 1 раз в год. Пациенты III группы (6 наблюдений) с метафизарными фиброзными дефектами, характеризующимися перифокальным остеолизом и ростом патологической ткани, обследовались с частотой 1 раз в 6 месяцев. При появлении жалоб, а также в периоды физиологических «скачков роста» вносились соответствующие коррективы в план наблюдения за ребёнком. С целью объективной оценки динамики течения процесса (увеличение очага, спонтанная оссификация, отсутствие динамики) придерживались установки, согласно которой очередная рентгенография выполнялась при соблюдении режимных условий и укладки, аналогичных предыдущему рентгенологическому исследованию. Оперативное лечение было показано: 1. Пациентам с неоссифицирующимися фибромами, характеризующимися остеолизом и формированием вторичных деформаций поражённого сегмента конечности, независимо от размеров костного очага (пациенты V группы). 2. Пациентам с неоссифицирующимися фибромами с признаками ос-теорепарации при размерах очага, занимающих более половины поперечника трубчатой кости (пациенты IV группы). Выбор хирургической тактики лечения определялся, в первую очередь, активностью и размерами патологического очага, и, как следствие, низкими прочностными характеристиками кости, риском развития патологического перелома и формирования вторичных деформаций поражённого сегмента конечности. Основу оперативного лечения составляло радикальное удаление патологической ткани – резекция очага в пределах неизменённой кости, а при наличии показаний – устранение деформации и укорочения конечности. Сведения о выполненных оперативных вмешательствах представлены в таблице 18. Из таблицы видно, что наиболее часто (53 патологических очага) выполнялась краевая резекция с пластикой пострезекционного дефекта различным костнопластическим материалом. В 3 случаях, при наличии соответствующих показаний, это оперативное вмешательство дополнялось корригирующей остеотомией костей и фиксацией костных фрагментов аппаратом Илизарова. У 2 пациентов с поражением всего поперечника малоберцовой кости произведена субпериостальная сегментарная резекция. Этот вид оперативного вмешательства является основным у пациентов с неоссифицирующимися фибромами и при адекватном объёме резекции гарантирует полное излечение. Хирургическое вмешательство выполняется под жгутом (за исключением операций на проксимальном отделе плеча). Доступ к патологическому очагу осуществляется с учётом его анатомо-топографического расположения. Производится продольный разрез кожи и подкожно-жировой клетчатки, рассекается собственная фасция, расслаиваются мышцы. Поражённый отдел трубчатой кости выделяется поднадкостнично. С помощью долота на всём протяжении зоны поражения иссекается участок компактной кости, достаточный для полноценной обработки патологического очага. Содержимое последнего удаляется долотами, на приграничных участках резекция осуществляется в пределах неизменённой костной ткани. Образовавшаяся полость промывается 3% раствором перекиси водорода и просушивается. С помощью электрокоагулятора осуществляется гемостаз. Пострезекционный дефект заполняется костнопластическим материалом. С этой целью нами использовались смесь измельчённых замороженных и деминерализованных кортикальных аллотрансплантатов в соотношении 1:1 (28 наблюдений), «щебёнка» из замороженных кортикальных аллотрансплантатов (23 наблюдения) и гидроксиапатитколлагеновый материал «ЛитАр» (2 наблюдения). После пластики надкостница сшивается над дефектом кости, снимается жгут, производится гемостаз. Послеоперационная рана ушивается послойно. Выполняется рентгенография области хирургического вмешательства в двух стандартных проекциях.
Фиброма кости у детей
Наиболее распространенными типами являются:
Неоссифицирующие:
Cостоят из фиброзной ткани и крепятся непосредственно к кости. Обычно встречаются в активно растущих секциях длинных костей, таких как расширяющийся конец нижней бедренной кости и голень. Иногда поражают плечевую кость. Чаще встречаются у представителей мужского пола. Хирургического вмешательства не требуют. Такая фиброма у ребенка на ноге может исчезнуть без какого-либо лечения, когда малыш окрепнет.
Симптомы:
Некоторые дети чувствуют отек и болезненность на ощупь. 2% маленьких пациентов жалуются на постоянную тупую боль, не связанную с физической деятельностью. Иногда причина кроется в микротрещине или незначительном переломе.
Гетеропластическая остеома:
Экзофитная масса, состоящая из соединительной ткани костей черепа и придаточных пазух носа. Иногда классифицируется как аномалия развития.
Симптомы:
На ощупь твердая, круглая, безболезненная опухоль. Достигая больших размеров, фиброма на голове у ребенка способна надавливать на черепную коробку, деформируя ее и вызывая боль, отечность, проблемы деятельности головного мозга.
Остеоидная остеома:
Небольшое уплотнение, что растет в длинных нижних конечностях человека или позвоночнике. У детей стимулируется быстрым развитием и может вызвать деформацию костных структур.
Остеохондрома (экзостоз):
Остеохондрома возникает из коры длинной кости, прилегающей к пластине. Фиброма коленного сустава у детей обычно содержит костные и хрящевые элементы, поэтому преимущественно развивается в нижнем конце бедренной или берцовой кости (голени), а также в предплечье.
Простые кисты:
Заполненные жидкостью образования, поверхность которых состоит из фиброзных соединений. Обычно происходят в верхних конечностях и в плечевом поясе. Такая фиброма, прежде всего, влияет на детей от 5 до 15 лет, но встречается и в старшем возрасте.
Бессимптомные, но проявляются патологическими переломами даже после незначительных травм.
Лечение отличается от терапии иных фибром и включает инъекции аспирации, препарата “Метилпреднизолон” или костного мозга.
Неостеогенная фиброма:
Образовывается в конечностях. Обнаруживается случайно на рентгене. Требует удаления только тогда, когда ослабляет кость.
Опухоли мягких тканей
Фиброма кожи у детей
В основном, представлена папулезными и узловыми повреждениями. Среди них выделяются:
Гладкий, телесного цвета узелок на широкой основе. Локализуется на пальцах ног и развивается первые 12 месяцев после рождения. Требует различения с фибросаркомой.
Образования склонны к спонтанной регрессии, а также рецидивам после удаления, поэтому хирургия в качестве основного лечения не рекомендована.
Опухоль шпинделя клеток, представлена узелком телесного или коричневого цвета. Дифференцируются диффузные, пигментные или плексиморфные варианты. Последние склонны к злокачественной трансформации. Особенно выделяется фиброма на руке у ребенка, которая может присутствовать при рождении и возникать в подростковые годы.
Узелки всех оттенков красного, а также синеватого и фиолетового цветов. Абсолютно безопасные и не нуждаются в терапии.
Волокнистая папула, что образуется из волосяной луковицы и напоминает внутрикожный невус. Возникает в детстве, с годами темнеет.
Оральные доброкачественные поражения
Волокнистые нераковые наросты, что называют опухолями. Но за отличающими особенностями это скорее гиперплазия, что формируется в результате реакции на какой-то раздражитель или обусловлена генетически. Гистологически представляет шаровидное твердое тело, что может периодически воспаляться.
- Фиброма у ребенка на десне:
На вид овальной яйцевидной формы, характеризуется как сидячая или на ножке. Поверхность гладкая, но вследствие частых травм может быть изъязвленной или покрытой гиперкератозом.
Представляет собой группу из инфильтрирующих волокнистых пролифераций, что являются промежуточным вариантом между доброкачественными и злокачественными поражениями. Обычно диагностируется у пациентов моложе 10 лет. Фиброматоз десен ‒ отдельное состояние, что может быть наследственным или индуцированным препаратами. Наросты имеют ороговевший воспаленный вид.
Фиброма кости челюсти
Фиброма у детей: лечение и удаление
Как описывалось выше, фиброма у ребенка нуждается в терапии только в тех случаях, когда симптомы мешают жизнедеятельности.
К общим терапевтическим мероприятиям относятся:
Наиболее эффективные и простые способы удаления фибромы у ребенка. Во время операции опухоль соскабливают с помощью специального инструмента, что имеет совок, петлю или кольцо на кончике. Излишек жидкости отсасывают. Оставшуюся полость заполняют собственными донорскими тканями, изъятыми из иных участков тела или кусочками из других материалов.
2. Стероидная инъекция:
В некоторых случаях стероидная инъекция может помочь излечить фиброму кости у ребенка без хирургических методов. Ученые считают, что такой эффект происходит из-за способности стероидов снижать уровни простагландина ‒ типа жирной кислоты, что образовывается в кистах.
3. Инъекции костного мозга:
Необходимые вещества отсасывают из костей бедра и вводят в кистозное уплотнение. Такая процедура способствует быстрому заживлению. Иногда используется в сочетании с деминерализованным костным гелем, чтобы стимулировать образование новых тканей. Прогноз лечения позитивный, но случается небольшое количество рецидивов.
Фиброма у детей ‒ не агрессивное заболевание, что зачастую не требует применения каких-либо радикальных мер и решений.
Что это такое?
Неостеогенная или неоссифицирующаяся фиброма встречается не только у людей преклонного возраста, но и у детей, подростков. Такие патологические изменения в организме требуют медицинского вмешательства. Неостеогенные фибромы ― доброкачественные новообразования, состоящие из тканей, клетки которых синтезируют внеклеточную структуру.
К неостеогенной фиброме относится поражение берцовой или бедренной кости. Для патологии характерно растворение наружного костного слоя, который образует корку кости. Трубчастый отдел, который прилегает к хрящевой пластине, тоже растворяется. После процесса резорбции трубчастого отдела его замещает эпифизарная линия. Внешний костный слой заменяет фиброзная ткань, которая служит строительным материалом для сухожилий и неспособна полноценно воссоздать костную кору. По причине такого патологического замещения возникают неестественные переломы рук и ног.
Форма фибромы
Фиброма большеберцовой кости имеет характерный продолговатый внешний вид. Края поврежденной кости окружены клетками и волокнами, внешне напоминающими странные пучки. Из чего образуются эти переплетения. приведено в таблице:
Неостеогенная фиброма может состоять из фибробластов, коллагена, липоцитов или их комбинации.
| Биоматериал | Краткое описание |
| Коллагеновое белковое волокно | Входит в состав соединительных тканей. Такие волокна выполняют механическую роль. Имеют низкую эластичность. |
| Клетки, вырабатывающие внеклеточное вещество (фибробласты) | Внеклеточное вещество считается главным строительным материалом для соединительных тканей и обеспечивает механическую поддержку для клеток. Фибробласты содействуют выделению химического материала из клетки (например, эластина). |
| Клетки-липоциты | Образуют рубцовую ткань. |
| Клеточные элементы | Их наличие подтверждает воспалительный процесс в костных тканях. |
Этиология и патогенез
В группе риска находятся пациенты, которым был поставлен диагноз нейрофиброматоз. В большинстве случаев, неостеогенная болезнь возникает в первые 20 лет жизни, в более старшем возрасте встречается редко. Мальчики страдают от неостеогенной фибромы намного чаще, чем девочки.
Неостеогенная фиброма может сходить сама по себе, но есть риск перерождения в онкологию.
Причины возникновения опухолевого изменения кости не выяснены. Заболевание проявляется как очаговое рассасывание костной ткани и преобразование ее в фиброзную структуру. Зачастую неостеогенные фибромы исчезают самостоятельно. Доброкачественная опухоль не представляет большой опасности, но все же существует несколько факторов, способных негативно повлиять на развитие новообразования и дальнейшие последствия:
- возможность перерождения в злокачественную опухоль;
- чрезмерное увеличение фибромы провоцирует нарушение мышечной и костной деятельности;
- механическое повреждение новообразования (травма, удар) провоцирует начало воспалительного процесса и развитие вторичной инфекции.
Симптоматика
Признаки и симптомы развития неостеогенной фибромы практически во всех случаях отсутствуют до патологического перелома кости. Иногда неостеогенную фиброму кости обнаруживают при проведении рентгенологического исследования, которое назначается по другим причинам. Главный признак неостеогенной фибромы — неестественные переломы, большая часть которых приходится на нижние конечности. Другие признаки заболевания:
- при рентгенологическом исследовании на снимке четко просматриваются пористые ткани;
- общие анализы показывают недостаточное количество кальция в организме;
- нарушенный фосфорно-кальциевый обмен, и возникшие патологические процессы, разрушающие костную ткань и препятствующие ее самовосстановлению.
Особенности образования у детей
Неостеогенная фиброма снижает прочность костей, а это весьма опасно по причине чрезвычайной детской активности.
Процесс развития неостеогенной фибромы у детей начинается из медленного истончения внешнего слоя костной ткани. Рост новообразования провоцирует безболезненное рассасывание костной ткани. На конечной стадии истончения кардинально преобразуется плотность костных тканей, что негативно воздействует на общее строение кости. Пластинки перестают выполнять свои функции, и больше не выстраиваются по линиям сжатий и растяжений Такое состояние вызывает снижение стойкости к физической нагрузке.
Фиброма кости считается дефектом внешнего костного слоя, который расположен в длинном трубчатом твердом образовании в человеческом организме. Дефект выглядит как многокамерные образования, похожие на маленькие отверстия. Лечение неостеогенной фибромы назначается в редких случаях. Так как пористая ткань постепенно самопроизвольно излечивается. На ранней стадии клиническая картина не даст возможности диагностировать болезнь из-за отсутствия симптомов и самостоятельного рассасывания фибромы.
Как происходит лечение неоссифицирующей фибромы?
Неоссифицирующая фиброма имеет уникальное свойство самостоятельно рассасываться. Это считается наиболее подходящим восстановлением. Минус такого лечения заключается в том, что самостоятельное восстановление костной ткани иногда затягивается на длительное время. Чтобы ускорить выздоровление, врач назначает прием медикаментов. Хирургическим методом выполняют резекцию кости (удаление пораженной части). Иногда проводят вырезание пораженного участка над костью. В этом случае разъединяются здоровые и пораженные ткани, надкостница отслаивается при помощи распаратора и перепиливается с 2-х концов поврежденной области.
Хирургическая операция производится только в крайних случаях, когда кортикальная кость истощается более чем наполовину. При переломах опухоль обычно выскабливают для ускорения срастания сломанной кости.
Когда операцию проводят в области гибких тканей и хрящей, поврежденные участки суставов удаляют и заменяют их специальными имплантатами. Часто используют лучевую терапию, чтобы остановить или замедлить рост опухоли, и чтобы уничтожить опухолевые клетки. Важно помнить, что методику лечения неостеогенной фибромы и ее целесообразность должен определять исключительно врач. Самолечение и нарушение медицинских рекомендаций может повлечь за собой тяжелые последствия. Опухоль имеет способность распространяться и тем самым оказывает негативное влияние на общее состояние организма.
- http://www.dslib.net/travmatologia/neossificirujuwajasja-fibroma-kosti-u-detej.html
- https://orake.info/fibroma-u-detej-foto-udalenie-posledstviya/
- http://StopRodinkam.ru/kondilomy/neossificiruyushhayasya-fibroma.html
yazdorov.win
Неоссифицирующая фиброма (фиброзный кортикальный дефект).
Автор: Oleg Kruglov
Неоссифицирующая фиброма – это наиболее распространённое неопухолевое фиброзное поражение костей. По своей природе это более крупный вид фиброзного кортикального дефекта (< 3 см); оба состояния отражают термин фиброксантома или метафизарный фиброзный дефект.
Эпидемиология
Неоссифицирующая фиброма очень часто встречается у детей и подростков и является наиболее частыми фиброзным поражением костей в этой возрастной группе, с пиком выявляемости 10-15 лет [4]. Распространенность составлеят до 30-40% среди здоровых детей. У мальчиков встречается в два раза чаще чем у девочек [6]. Обычно не встречается после 30 лет, поскольку самостоятельно спонтанно излечивается, постепенно замещаясь костной тканью.
Клиническая картина
Большинство неоссифицирующих фибром бессимптомны. Крупные поражения могут быть болезненными и, ослабляя кость, являться предрасполагающим фактором для возникновения патологического перелома. Множественные неоссифицирующие фибромы сочетаются с нейрофиброматозом I типа, фиброзной дисплазией и синдромом Яффе—Кампаначи (Jaffe-Campanacci syndrome). Редко неоссифицирующая фиброма может вызывать гипофосфатемический витамин-D-резистентный рахит [5].
Патология
Неоссифицирующая фиброма макроскопически представляет собой мясистое, волокнистое, желтое или коричнево-коричневое поражение с участками кровоизлияния [3]. Микроскопически поражение характеризуется высокой клеточностью, с наличием веретеновидных клеток, на фоне стромы, формируя так называемый «муаровый» узор. Встречаются пенистые гистиоцит и многоядерные гигантские клетки. Митотические фигуры и /или дисплазия не характерны для фиброксантомы [3]. Считается, что костные островки являются самоизлечившимися фиброксантомами.
Диагностика
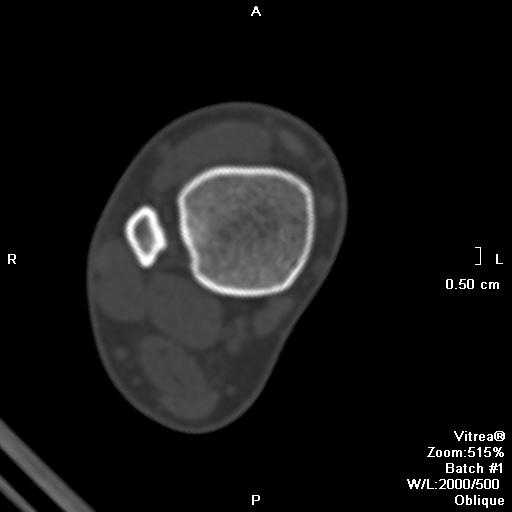
Рентгенография /Компьютерная томография
Неоссифицирующая фиброма характеризуется дольчатой формой, обычно имеет склеротический ободок. Локализуются эксцентрично, в прилежащем к ростовой пластинке метафизе. С ростом пациента, смещается и отдаляется от ростовой пластинки. Не сочетается с периостальной реакцией, нарушением целостности кортикальной пластинки и не имеет мягкоткпнного компонента.
Магнитно-резонансная томография
МР картина разнообразная и зависит отдлительности заболевания и репаративной фазы, при которой получены изображения. В начале заболевания, поражение характеризуется высоким или промежуточным сигналом на Т2 взвешенных изображениях, окружённым по периферии низкоинтенсивным ободком, отражающем склеротическую границу. С началом оссификации сигнал становится низкоинтенсивным на всех последовательностях [2]. Контрастное усиление варьирует.
Сцинтиграфия
Данные сцинтиграфии зависят от фазы поражения. В целом они отрицательны; однако, во время процессов репарации присутсвуют умеренная гиперемия и умеренное поглащение. Если имеется выраженное поглощение или гиперемия, следует рассмотреть альтернативный диагноз или заподозрить перелом [3].
Лечение и прогноз
Неоссифицирующая фиброма относится к категории поражений “не трогай и оставь меня в покое”. В подавляющем большинстве случаев не требует биопсии и лечения. При вовлечении в процесс более половины диаметра кости, с целью профилактики патологического перелома, выполняется кюретаж с графитнгом/замещением кости [1].
Дифференциальный диагноз
- фиброзный кортикальный дефект
- аневризмальная костная киста
- эксцетнтрический литический метафизарный дефект
- уровни жидкости при МР исследовании
- хондромиксоидная фиброма
- фиброзная дисплазия
- десмопластическая фиброма
Синонимы
- неоссифицирующая фиброма
- неоссифицированная фиброма кости
- фиброзный кортикальный дефект
- фиброксантома
- метафизарный фиброзный дефект
Использованные источники:
- Jee WH, Choe BY, Kang HS et-al. Nonossifying fibroma: characteristics at MR imaging with pathologic correlation. Radiology. 1998;209 (1): 197-202.
- Stacy GS, Dixon LB. Pitfalls in MR image interpretation prompting referrals to an orthopedic oncology clinic. Radiographics. 27 (3): 805-26.
- Betsy M, Kupersmith LM, Springfield DS. Metaphyseal fibrous defects. J Am Acad Orthop Surg. 12 (2): 89-95.
- Hod N, Levi Y, Fire G et-al. Scintigraphic characteristics of non-ossifying fibroma in military recruits undergoing bone scintigraphy for suspected stress fractures and lower limb pains. Nucl Med Commun. 2007;28 (1): 25-33.
- François S, Lefort G, Poli-Merol ML et-al. Vitamin-resistant rickets cured by removal of a bone tumor. Review of the literature. Rev Chir Orthop Reparatrice Appar Mot. 1998;83 (4): 387-92.
- Grove J, Robbins C. Nonossifying fibroma: a literature review and case report.
- A.Prof Frank Gaillard et al. Non-ossifying fibroma. Radiopaedia.
drivems.by
Кортикальный дефект бедренной кости: симптомы, лечение и прогноз
Причины образования патологии на сегодняшний день остаются не до конца изученными. Выявлена некоторая связь с генетически обусловленными системными заболеваниями соединительной ткани, в частности, крупные очаги поражения часто сопутствуют нейрофиброматозу I типа, фиброзной дисплазии, синдрому Яффе-Кампаначчи. Также отдельные исследования выявляют связь развития кортикального фиброзного дефекта с гипофосфатемическим витамин Д-резистентным рахитом.
В большинстве случаев этиология заболевания остается неясной. Патология выявляется случайно при рентгенологическом обследовании. Дефект нельзя отнести к редким: согласно статистике, у 30-40% детей в возрасте от 3 до 10 лет выявляются фиброзные очаги в метафизе и диафизе большеберцовой кости. Мальчики подвержены заболеванию вдвое чаще, чем девочки. У взрослых после закрытия ростковых зон костей фиброзный дефект не развивается. Как правило, к 13-14 годам наблюдается ремиссия патологии, и очаги фиброзной ткани замещаются нормальной костной тканью.
Случаев озлокачествления фиброзных новообразований в медицинской литературе не описано.
Клиническая картина
Фиброзный кортикальный дефект обнаруживается чаще всего в метафизе и диафизе большеберцовых костей, в местах прикрепления активных мышц, и представляет собой опухолеподобное очаговое перерождение тканей. Очаги представлены волокнистой фиброзной тканью с включениями гигантских клеток, а в некоторых случаях – рассеянных в фиброзной ткани веретенообразных и ксантомных клеток: нагруженных холестериновым эфиром макрофагов, перерожденных моноцитов. Также внутри фиброзных очагов могут быть обнаружены лимфоциты и плазменные клетки как следы воспалительной реакции.
Очаги чаще всего возникают первично на периостальной поверхности, с течением времени распространяются интра- и субкортикально. В редких случаях новообразование заполняет весь поперечник кости. Если очаги имеют склонность к быстрому росту и распространению, заболевание классифицируют как неоссифицирующую фиброму и причисляют к доброкачественным новообразованиям, подлежащим оперативному лечению.
Отмечались ситуации, когда у пациента в кости одной конечности наблюдался фиброзный кортикальный дефект, а в другой – неоссифицирующая фиброма, что позволяет высказать предположение об общей природе их возникновения. При дифференциации фиброзного кортикального дефекта от неоссифицирующей фибромы принимают во внимание степень вовлечения в патологию костномозгового канала: ФКД не затрагивает его, а неоссифицируущая фиброма имеет тенденцию к прорастанию внутрь канала.
В отличие от кортикального дефекта, не выявляемого при прощупывании, фиброма может проявлять себя как припухлость плотной консистенции, неподвижная, не спаянная с кожей, слегка болезненная при пальпации.
При наличии фиброзного дефекта большеберцовой кости и при неоссифицируемой фиброме общее состояние больного остается удовлетворительным. Клинические анализы крови не позволяют выявить никаких характерных особенностей данных состояний.
Стоит отметить, что в медицинских кругах нет единого мнения о дифференциации ФКД и неоссифицирующей фибромы. Ряд специалистов считают их двумя разновидностями течения одной патологии, другие относят фиброму к опухолевым заболеваниям костной ткани, а ФКД не патологией, а дефектом или особенностью развития и роста костной ткани. Существует также мнение, что ФКД и неоссифицирующая фиброма являются разными стадиями течения одного заболевания.
Читайте также: 5 игр с гимнастикой (ЛФК) при плосковальгусной стопе у детейПатология развивается бессимптомно и не сопровождается болевыми ощущениями или нарушениями подвижности конечностей. Однако в случаях масштабного замещения костной ткани фиброзной существенно снижается прочность кости, что может привести к патологическим переломам.
Диагностика кортикального дефекта
На рентгенологическом снимке обнаруживаются светлые очаги с четко очерченными границами склерозированной ткани, также наблюдается вздутие кортикального слоя. В случае неоссифицирующей фибромы в патологический процесс включен костномозговой канал.
Сцинтография при диагностике кортикального дефекта в большинстве случаев оказывается неэффективной и не позволяет выявить патологию. В отдельных случаях наблюдаются очаги умеренного поглощения и умеренной гиперемии. При обнаружении выраженного поглощения и гиперемии можно заподозрить перелом.
Патологию следует дифференцировать от других опухолевых образований костной ткани.
- Доброкачественная фиброзная гистоцитома отличается от фиброзного кортикального дефекта тем, что на рентгенографическом снимке не выявляется. Также фиброзная гистоцитома может вызывать болезненные ощущения.
- Фиброзная дисплазия имеет везикулярную форму, развивается от центра кости.
- Периостальный десмоид выявляется в значительно более позднем возрасте – от 12 до 20 лет.
Процесс заживления очагов фиброзной ткани на рентгенографическом снимке следует отличать от процесса злокачественной резорбции тканей.
Эпидемиология
Неоссифицирующая фиброма очень часто встречается у детей и подростков и является наиболее частыми фиброзным поражением костей в этой возрастной группе, с пиком выявляемости 10-15 лет [4]. Распространенность составлеят до 30-40% среди здоровых детей. У мальчиков встречается в два раза чаще чем у девочек [6]. Обычно не встречается после 30 лет, поскольку самостоятельно спонтанно излечивается, постепенно замещаясь костной тканью.
Патология
Неоссифицирующая фиброма макроскопически представляет собой мясистое, волокнистое, желтое или коричнево-коричневое поражение с участками кровоизлияния [3].Микроскопически поражение характеризуется высокой клеточностью, с наличием веретеновидных клеток, на фоне стромы, формируя так называемый «муаровый» узор. Встречаются пенистые гистиоцит и многоядерные гигантские клетки. Митотические фигуры и /или дисплазия не характерны для фиброксантомы [3]. Считается, что костные островки являются самоизлечившимися фиброксантомами.
Неоссифицирующая фиброма характеризуется дольчатой формой, обычно имеет склеротический ободок. Локализуются эксцентрично, в прилежащем к ростовой пластинке метафизе. С ростом пациента, смещается и отдаляется от ростовой пластинки. Не сочетается с периостальной реакцией, нарушением целостности кортикальной пластинки и не имеет мягкоткпнного компонента.
Данные сцинтиграфии зависят от фазы поражения. В целом они отрицательны; однако, во время процессов репарации присутсвуют умеренная гиперемия и умеренное поглащение. Если имеется выраженное поглощение или гиперемия, следует рассмотреть альтернативный диагноз или заподозрить перелом [3].
Лечение и прогноз
Неоссифицирующая фиброма относится к категории поражений “не трогай и оставь меня в покое“. В подавляющем большинстве случаев не требует биопсии и лечения. При вовлечении в процесс более половины диаметра кости, с целью профилактики патологического перелома, выполняется кюретаж с графитнгом/замещением кости [1].
Метафизарный фиброзный дефект кости обнаруживается почти исключительно в метафизах длинных трубчатых костей у детей и подростков при рентгенографии, выполненной часто без всяких предшествующих жалоб по разным поводам (травма или для сравнения при жалобах со стороны противоположного сустава).
Метафизарный фиброзный дефект кости (другие названия: фиброзный корковый дефект, неоссифицирующая фиброма, кортикальная лакуна) — явно неопухолевый дефект костной ткани. Такие новообразования встречаются очень часто, могут протекать бессимптомно и бывают случайной находкой при рентгенологическом исследовании. Морфологически эти очаги состоят из волокнистой соединительной ткани с фибробластами и рассеянными гигантскими клетками, в части случаев, особенно при длительно существующих очагах, содержат примесь ксантомных клеток.
Характер метафизарного фиброзного дефекта кости не соответствует представлениям об опухолях и позволяет рассматривать эти находки как очаговую перестройку костной ткани, начинающуюся с резорбции и завершающуюся ее воссозданием. Причина такой перестройки не выяснена. Метафизарный фиброзный дефект кости в 90% случаев возникает в метафизах длинных костей, чаще всего нижних конечностей. Они начинаются на периостальной поверхности и, увеличиваясь в размерах, смещаются интракортикально, а затем субкортикально, сохраняя эксцентрическое положение даже при значительных размерах. Только в более тонких костях (малоберцовой) они могут занимать весь поперечник.
В некоторых случаях очаги с такой гистологической картиной достигают больших размеров, продолжают увеличиваться при динамическом наблюдении. При этом они могут потребовать более активной тактики вплоть до хирургической резекции. Очаги с такими особенностями расценивают как опухоли — неоссифицирующие фибромы.
Противопоставление неоссифицирующих фибром как опухолей типичным МФД как неопухолевым поражениям нельзя считать оправданным, учитывая одинаковую гистологическую картину и тот факт, что во всех таких очагах может восстанавливаться нормальная костная структура.
Озлокачествление метафизарного фиброзного дефекта кости и неоссифицирующих фибром не описано.
Некоторые авторы выделяют фиброзную гистиоцитому, которая гистологически идентична неоссифицирующей фиброме.
Новообразования
Большая часть дефектов костей вызвана этой категорией заболеваний.
Дефекты костей доброкачественного происхождения встречаются довольно часто и обычно обнаруживаются случайно при рентгенологическом исследовании по поводу травмы.
Такие дефекты обычно протекают бессимптомно и имеют довольно характерную локализацию.
Злокачественные дефекты костей могут быть первичными или вторичными. Вторичное поражение кости опухолью встречается гораздо чаще, чем первичная опухоль костей. Ниже описаны наиболее типичные проявления некоторых из этих опухолей.
Фиброзный дефект кортикального слоя
Фиброзный дефект кортикального слоя (рис. 124). Это один из вариантов нормы, представляющий собой участок остеолиза, рентгенологическое изображение которого настолько характерно, что для подтверждения диагноза не требуется никаких дополнительных диагностических методов.
Рис. 124. Аксиальная рентгенограмма проксимального отдела большеберцовой кости ребенка 9 лет.
Обнаруживаются типичные фиброзные дефекты кортикального слоя.
zdorovo.live
Неоссифицирующая фиброма (метафизарный фиброзный дефект)
Неоссифицирующая фиброма (НОФ) — часто встречающееся доброкачественное поражение костей у детей и подростков, состоящее из пролиферирующих вытянутых фибробластов, в сочетании с вариабельным количеством гигантских многоядерных остеокластоподобных клеток [7]. Существует несколько синонимов: метафизарный фиброзный дефект (МФД), кортикальный фиброзный дефект (КФД), гистиоцитарная фиброма и фиброзная ксантома. Если речь идет о небольших поражениях кортикального слоя, чаще употребляется термин МФД или КФД. Когда поражение распространяется медуллярно, а тем более при возникновении угрозы патологического перелома, используется термин НОФ.
В большинстве случаев НОФ не имеет клинической симптоматики и, как правило, является случайной находкой во время обследования. При активно увеличивающихся поражениях иногда появляются жалобы на локальную болезненность [10]. Часть исследователей рассматривают НОФ не как истинную опухоль, а как локальный дефект остеогенеза в процессе роста костей скелета [1]. Множественный характер поражения встречается редко, чаще в рамках синдрома Яффе—Кампаначи (Jaffe—Campanacci syndrome), который, помимо множественных НОФ, характеризуется наличием светло-коричневых пятен на коже (Café au lait spots), может сопровождаться отставанием в умственном развитии, гипогонадизмом или крипторхизмом, пороками развития сердечно-сосудистой системы, глаз, а также сочетаться с нейрофиброматозом [3, 4].
Частота обнаружения МФД/НОФ достигает 30%. Поскольку клиническая симптоматика чаще всего отсутствует, истинная распространенность данной патологии остается неизвестной. МФД/НОФ регистрируется чаще у детей и подростков, редко в возрасте младше 5 лет и у взрослых старше 20 лет.
Несмотря на высокую распространенность данной патологии, осведомленность хирургов, специалистов лучевой диагностики и патологоанатомов в отношении последней остается крайне низкой.
Были проанализированы 678 случаев опухолей и опухолеподобных поражений костей у детей и подростков с января 2009 по июнь 2015 г. НОФ/МФД выявлены у 35 больных. В каждом случае анализировали данные анамнеза (пол, возраст, локализация, жалобы, проведенное лечение), рентгенологического (и/или КТ-исследования) и МРТ-исследования (при наличии) и гистологический материал. Всем больным произвели хирургическое лечение (экскохлеация). В каждом случае осуществляли дифференциальную диагностику с фиброзной дисплазией, аневризмальной костной кистой, гигантоклеточной опухолью, хондромиксоидной фибромой и десмопластической фибромой.
В нашем исследовании в структуре всех опухолей и опухолеподобных поражений костей у детей и подростков МФД/НОФ составили 5,16%.
Возраст больных варьировал от 7 до 18 лет, наибольшее количество наблюдений отмечалось в возрасте от 12 до 18 лет. Распределение по возрасту показано на рис. 1.
Рис. 1. Распределение МФД/НОФ по возрасту.
Множественный характер поражения наблюдался у одного пациента (мальчик, 14 лет) в дистальном метафизе левой бедренной и проксимальном метафизе левой большеберцовой кости. Пациенту выполнили экскохлеацию НОФ левой большеберцовой кости.
Количество пациентов женского пола незначительно преобладало над количеством пациентов мужского пола (20/15). Однако, по данным литературы, данная патология несколько чаще встречается у мальчиков [1].
Размер образования варьировал в широких пределах: от 0,8 см (в диаметре) до 8×5×4 см (случай осложнился патологическим переломом).
Как правило, жалобы на момент обнаружения образования отсутствовали. Часть больных отмечали непостоянные болевые ощущения при нагрузке. В основном болевой синдром был выражен при большом объеме поражения дистального метафиза бедренной кости. В 2 (5,71%) случаях выявлен патологический перелом вследствие большого объема поражения кости.
У двух детей отмечался рецидив образования после хирургического лечения (через 2 и 3 года соответственно).
НОФ/МФД чаще всего обнаруживаются в метафизах длинных трубчатых костей, в подавляющем большинстве в костях нижних конечностей (дистальный метафиз бедренной кости, проксимальный и дистальный метафизы большеберцовой и малоберцовой костей). Самой распространенной локализацией, по нашим наблюдениям, были дистальный метафиз бедренной кости и проксимальный метафиз большеберцовой кости (рис. 2).
Рис. 2. Локализация МФД/НОФ в наших наблюдениях.
Клинический диагноз до проведения хирургического лечения в большинстве случаев (22, 62,85%) — фиброзная дисплазия, в 3 (8,57%) наблюдениях — гигантоклеточная опухоль, в 2 (5,71%) — остеомиелит, в 1 (2,85%) — остеоид остеома, в 1 (2,85%) — остеосаркома, в 3 (8,57%) — опухоль кости без уточнения. Диагноз кортикальный фиброзный дефект был поставлен до оперативного лечения лишь у 3 (8,57%) больных, что напрямую свидетельствует о низком уровне осведомленности о данной патологии хирургов и специалистов лучевой диагностики.
В одном случае (девочка 10 лет) поставлен морфологический диагноз гигантоклеточная опухоль ввиду большого количества гигантских многоядерных остеокластоподобных клеток. Однако при пересмотре рентгеновских снимков (хорошо ограниченный овальный очаг поражения в кортикальном слое дистального метафиза бедренной кости с перифокальной зоной склеротических изменений) и гистологического материала (веретеноклеточное поражение, шториформный паттерн, митотическая активность не обнаружена, группы ксантомных клеток, депозиты гемосидерина), а также, учитывая возраст (гигантоклеточная опухоль казуистически редко встречается у детей и подростков), диагноз был изменен на МФД.
МФД/НОФ локализуются в метафизах длинных трубчатых костей и по мере роста костей скелета могут немного смещаться в сторону диафиза. Хорошо известно, что области метафиза и ростковой пластинки являются местами наиболее интенсивного роста костей у детей и подростков. Следовательно, МФД/НОФ как локальный «дефект остеогенеза» возникают в этой зоне. Некоторые авторы считают, что пусковым механизмом для развития МФД/НОФ может служить незначительная травма с субпериостальным кровоизлиянием [5]. Большинство поражений возникает вокруг коленного сустава, но описаны случаи возникновения и в костях таза, позвонках, ключице [8], даже в нижней челюсти [1, 2]. Однако при исследовании опухолей нижней челюсти в первую очередь следует проводить дифференциальную диагностику с гигантоклеточной репаративной гранулемой.
Описан случай сочетания НОФ с остеосаркомой дистального метафиза бедренной кости у 15-летней девочки [10].
При рентгенологическом исследовании МФД выглядит как округлое или овальной формы литическое образование кортикального слоя (или субпериостально), чаще немного вытянутое параллельно оси кости. Границы четкие, как правило, хорошо заметна небольшая зона остеосклероза вокруг (рис. 3). По мере роста МФД начинает распространяться в медуллярном направлении. Поэтому НОФ всегда выглядит эксцентрично, но также с четкими границами и зоной перифокальных остеосклеротических изменений (рис. 4). При больших поражениях, занимающих более трети—половины поперечника кости, часто можно обнаружить дольчатость за счет склерозированных септ, в составе которых при гистологическом исследовании определяется фиброзная ткань с очагами реактивного остеогенеза. В данных случаях заболевание может манифестировать патологическим переломом. В редких случаях контуры НОФ могут выходить за анатомические пределы кости. Периостальная реакция в большинстве случаев отсутствует.
Рис. 3. Хорошо ограниченный кортикальный очаг поражения в зоне дистального метафиза бедренной кости. Перифокальные склеротические изменения не выражены. Стадия, А по Ritschl.
Рис. 4. Хорошо ограниченный очаг поражения дистального метафиза большеберцовой кости с выраженным перифокальным склерозом, больше выраженным в области диафизарного полюса образования. Стадия D по Ritschl.
P. Ritschl и соавт. [6] описали процесс эволюции МФД и НОФ от их возникновения до полного склерозирования, основываясь на рентгенологических данных и выделили 4 стадии: A, B, C и D. Стадия A: небольшой кортикальный округлый или овальный эксцентричный очаг расположен вблизи зоны роста (близко к эпифизу). Зона перифокального склероза практически отсутствует. Стадия B: очаг поражения дистанцируется от эпифиза, приобретает неправильные поликистозные очертания, появляется тонкий склеротический ободок по периферии. Стадия C: склеротические изменения становятся выраженными, причем начинаются, как правило, с диафизарного полюса образования. Стадия D: образование полностью замещается гомогенной зоной склеротических изменений. Затем МФД/НОФ замещаются нормальной костной тканью и не выявляются рентгенологически. Активный рост МФД и НОФ происходит на стадиях A и B, при выявлении образования в стадиях B и C увеличения в размерах в динамике не наблюдалось.
Рентгенологическая картина НОФ/МФД настолько типична, что в подавляющем большинстве случаев диагноз может быть поставлен только на основании данного исследования. Поскольку НОФ/МФД относятся к группе костных поражений «leave me alone lesion», это служит основанием для наблюдения и периодического рентгенологического контроля. В связи с тем что НОФ/МФД способны регрессировать самопроизвольно во время роста и созревания костей скелета, активная хирургическая тактика далеко не всегда оправдана. Оперативные методы лечения применяются только при больших объемах образования, когда возникает угроза патологического перелома или НОФ манифестирует клинически патологическим переломом.
По системе стадирования Enneking доброкачественных опухолей НОФ/МФД в большинстве случаев имеют I стадию (G0T0M0), в редких случаях при распространении за пределы нормальных анатомических границ кости — II.
При макроскопическом исследовании поражение четко ограничено, желтовато-серого цвета (рис. 5). Могут встречаться кистозные изменения, очаги кровоизлияний. Участки некроза могут быть выявлены после патологического перелома.
Рис. 5. При макроскопическом исследовании поражение четко ограничено, желтовато-серого цвета.
При гистологическом исследовании образование хорошо ограничено, состоит из фибробластоподобных веретеновидных клеток, образующих хаотично ориентированные пучки и шториформные структуры (рис. 6). Ядра овальной или вытянутой формы, мелкие ядрышки выявляются не во всех ядрах. Митотическая активность достоверно не определяется или обнаруживаются немногочисленные фигуры митоза. Одним из постоянных морфологических признаков является выявление кластеров крупных гистиоцитов или ксантомных клеток с обильной светлой цитоплазмой. Почти всегда можно обнаружить мелкие рассеянные гранулы гемосидерина, которые лучше видны при специальной гистохимической окраске на железо. Часто можно выявить скопления гигантских многоядерных остеокластоподобных клеток (рис. 7). Нередко обнаруживаются кистозные изменения по типу вторичной аневризмальной костной кисты. При большом объеме образования могут быть выявлены зоны реактивного остеогенеза в виде грубоволокнистой костной ткани (woven bone), зоны гипоклеточной зрелой соединительной ткани. Если НОФ осложнилась патологическим переломом, часто определяются зоны некротических изменений.
Рис. 6. Типичная гистологическая картина МФД/НОФ. Веретеноклеточный компонент, кластеры ксантомных клеток и депозиты гемосидерина. Окраска гематоксилином и эозином, ×400.
Рис. 7. МФД/НОФ всегда четко ограничены, местами могут содержать большое количество гигантских многоядерных остеокластоподобных клеток. Окраска гематоксилином и эозином, ×300.
Дифференциальную диагностику следует проводить с фиброзной дисплазией, аневризмальной костной кистой, гигантоклеточной опухолью, хондромиксоидной фибромой и десмопластической фибромой.
Фиброзная дисплазия по определению — доброкачественное медуллярное фиброзно-костное поражение, при котором в патологический процесс вовлекается одна или несколько костей. Чаще встречается в костях черепа и бедренных костях, реже — в ребрах, костях таза и др. Рентгенологически выглядит, как хорошо ограниченное поражение, но в отличие от МФД не локализуется кортикально. НОФ — всегда эксцентричное образование, распространяющееся медуллярно из кортикального слоя. При гистологическом исследовании фиброзная дисплазия состоит из двух компонентов: фиброзного (в виде относительно гипоклеточной зрелой соединительной ткани с вытянутыми фибробластами) и костного (в виде причудливых костных трабекул, как правило, без перифокального остеобластического римминга). В НОФ костный компонент отсутствует, могут лишь определяться участки реактивного остеогенеза, особенно при наличии патологического перелома.
Редко встречается солидный вариант аневризмальной костной кисты (АКК). Чаще локализуется в длинных трубчатых костях. При рентгенологическом исследовании АКК, как правило, в виде литического очага хорошо ограничена, часто выходит за нормальные анатомические пределы кости, иногда четкая граница с мягкотканным компонентом может утрачиваться. При гистологическом исследовании нет выраженного шториформного паттерна как при МФД/НОФ, обнаруживаются множественные фокусы реактивного остеогенеза (woven bone). В первичной АКК обнаруживается t (16;17) с перестройкой гена UPS6.
Гигантоклеточная опухоль (ГКО) практически не встречается у детей и подростков, начинает регистрироваться в конце второй — начале третьей декады жизни, тогда как МФД/НОФ возникают у детей и подростков. Локализация эпифизарно-метафизарная, поражаются длинные трубчатые кости. Примерно в половине случаев диагностируется в костях вокруг коленного сустава: дистальной части бедренной кости, проксимальном метафизе большеберцовой и малоберцовой костей. При гистологическом исследовании мононуклеарный компонент чаще представлен неопластическими клетками овальной формы, ядра мононуклеаров в ГКО идентичны по морфологии ядрам многоядерных остеокластоподобных клеток [9].
Хондромиксоидная фиброма (ХФ) — доброкачественная опухоль, состоящая из вытянутых миофибробластоподобных и звездчатых клеток, с хондроидным и миксоидным матриксом. Может быть выявлена в любом возрасте. Чаще встречается в длинных трубчатых костях на второй и третьей декадах жизни, чаще среди пациентов мужского пола. Наиболее значимым клиническим симптомом является боль (от нескольких месяцев до нескольких лет). Рентгенологически обнаруживается в метафизах длинных трубчатых костей как резко ограниченный эксцентричный очаг, чаще без подчеркнутой зоны склеротических изменений в периферических отделах. В МФД/НОФ всегда хорошо определяется зона склероза по периферии. При гистологическом исследовании ХФ состоит из долек с относительно гипоклеточным центром и возрастанием клеточности к периферии. Клетки лежат в хондроидном и/или миксоидном межклеточном матриксе. Митотическая активность достоверно не определяется или низкая.
Десмопластическая фиброма (ДФ) — редкая доброкачественная локально агрессивная опухоль кости, состоящая из веретеновидных клеток и коллагенизированного матрикса. Является аналогом глубокого фиброматоза мягких тканей. Встречается в любом возрасте, в том числе у детей и подростков. В патологический процесс может вовлекаться любая кость, однако чаще возникает в нижней челюсти, метаэпифизарных зонах бедренной, большеберцовой, лучевой, плечевой костей, а также в костях таза. При рентгенологическом исследовании, как правило, контуры патологического очага выходят за анатомические границы кости. ДФ хорошо ограничена, часто имеет «сотовое» строение, иногда в патологический процесс вовлекаются мягкие ткани, в некоторых случаях наблюдается периостальная реакция, чего не бывает при МФД/НОФ. При гистологическом исследовании ДФ состоит из пучков веретеновидных фибробластоподобных клеток с выраженным коллагенизированным межклеточным матриксом. При иммуногистохимическом исследовании часто выявляется ядерная реакция с антителом к β-catenin.
1. МФД/НОФ являются одними из самых частых новообразований длинных трубчатых костей у детей и подростков.
2. МФД/НОФ имеют типичную рентгенологическую картину и не требуют хирургического лечения в подавляющем большинстве случаев.
3. МФД/НОФ следует дифференцировать с фиброзной дисплазией, аневризмальной костной кистой, гигантоклеточной опухолью, хондромиксоидной фибромой и десмопластической фибромой.
Конфликт интересов отсутствует.
www.mediasphera.ru
Вопросы дифференциальной диагностики костно-суставной патологии.
Болезни костно-суставной системы и соединительной ткани представляют актуальную медико-социальную проблему не только национального, но и мирового значения. Занимают одно из ведущих мест в структуре первичной и общей заболеваемости населения.
Являются наиболее частой причиной длительных болей и нетрудоспособности.
Структура костно-суставной патологии.
- дистрофические заболевания
- диспластические заболевания
- метаболические заболевания
- травма
- воспалительные заболевания
- неопластические заболевания
Вопросы, на которые должен ответить рентгенолог при обнаружении образования кости.
1 — неопластическое, инфекционное образование или результат дистрофических (диспластических) изменений или обменных нарушений 2 — доброкачественное или злокачественное 3 — первичное или вторичное образование
Необходимо использовать не скиалогический, а морфологический язык описания.
Цель лучевых исследований.
• Локализация • Количественная оценка: количество образований
инвазия.
• Качественная оценка: злокачественное или доброкачественное предположительный гистологический тип
• Предполагаемый диагноз: вариант нормы дистрофические/диспластические изменения нарушения обмена веществ (метаболические) травма воспаление опухоль

Важно.
Направительный диагноз • Возраст • Оценка результатов предыдущих исследований, анализов • Симптомы и результаты физикального обследования
• Моно – или полировальное поражение
 Оценка изменений в анализах • Остеомиелит – повышенное СОЭ, лейкоцитоз • Доброкачественные опухоли — нет изменений в анализах • Саркома Юинга – лейкоцитоз • Остеосаркома — повышение ЩФ • Метастазы, миеломная болезнь – анемия, повышение кальция в крови
• Миеломная болезнь – белок Бенс-Джонсона в моче
Оценка.
• Локализация образования • Число образований • Деструкция/склеротические изменения кости • Наличие гиперостоза • Тип периостальной реакции
• Изменения в окружающих тканях
Количественная оценка. • Первичные опухоли – чаще солитарные
• Метастазы и миелома – множественные
Группы основных изменений • изменениями формы и величины кости • изменениями контуров кости • изменениями костной структуры • изменения надкостницы, хряща
• изменения окружающих мягких тканей
Группы основных изменений. • Искривление кости (дугообразное, угловое, S -образное) • Изменение длины кости (укорочение, удлинение) • Изменение объема кости (утолщение (гиперостоз, гипертрофия), истончение, вздутие) • Изменение костной структуры остеолиз (деструкция, остеопороз, остеонекроз, секвестрация) – хорошо дифференцируемые, слабо дифференцируемые
• остеосклероз
Деструкция костной ткани.
• Доброкачественная — за счет экспансивного роста, повышения давления, надкостница сохраняется (долгое время), доброкачественная персональная реакция • Злокачественная — инвазивный рост, плохая дифференцировка краев,мягкотканыйкомпонент, злокачественная периостальная реакция, периостальная гиперплазия, рисунок «изъеденный молью»
Кортикальная деструкция.
Определяется при широком спектре патологии, воспалительных измениях доброкачественных и злокачественных опухолях. Полная деструкция может быть при высокодифференцированных злокачественных опухолях, при локальных агрессивных доброкачественных образованиях, таких как эозинофильная гранулема, при остеомиелите. Частичная деструкция может быть у доброкачественных и низкодифференцированных злокачественных опухолях. Фестончатость по внутренней поверхности (эндостальная) может при фиброзном кортикальном дефекте и низкодифференцированных хондросаркомах.
Вздутие кости так же является вариантом кортикальной деструкции — происходит резорбция эндоста и костеобразование за счет периоста, «неокортекс» может быть гладким, непрерывным и с участками прерывистости.
По данным рентгенографии при злокачественных мелко- круглоклеточных опухолях (саркома Юинга, мелкоклеточная остесакрома, лимфома, мезенхимальная хондросаркома) целостность кортикальной пластинки может быть сохранена, но, распространяясь чрез гаверсовы каналы, они могут формировать массивный мягкотканый компонент.
Типы персональной реакции.
- Солидный – линейный, отслоенный периостит
- «Луковичный» — слоистый периостит
- Спикулообразный – игольчатый периостит
- Козырек Кодмана (Codman) – периостит в виде козырька
- В отечественной практике деление на доброкачественный и агрессивные типы не используется и является противоречивым.
- Типы периостальной реакции Линейный периостит (слева)
Луковичный периостит (справа)
- Типы периостальной реакции Спикулообразный периостит (слева)
Козырек Кодмана (справа)
Кальцификация матрикса.
• Кальцинация хондроидного матрикса в хрящевых опухолях. Симптом «попкорна», кальцинация по типу хлопьев, по типу колец и дуг. • Кальцинация остеоидного матрикса в остеогенных опухолях. Трабекулярная оссификация. Может быть в доброкачественных (остеоид остеома) и злокачественных опухолях (остеогенная саркома)
Остеомиелит.
— бактериальное воспаление костного мозга после металлоостеосинтеза (чаще у взрослых) — ограниченный гнойный очаг с формированием деструкции (очаговый остеомиелит) — поверхностная форма – затрагивает кортикальный слой кости и окружающие мягкие ткани — распространенный тип остеомиелита – обширное поражение кости на фоне предшествующего процесса
— хронический остеомиелит – слоистые периостальные наслоения, происходит чередование процесса периостального костеобразования (периостоз) с образованием новой кости
— отек костного мозга (рентген негативная фаза, до 4 недель, метод выбора — МРТ ) — инфильтрация парасоссальных мягких тканей — гнойное воспаление костного мозга — некротизация костного мозга — очаги деструкции — образование секвестров
— распространение гноя вдоль мышечных структур, образование свищей
 Сравнительное изображение остеомиелита 1) остеогенная саркома 2) остеомиелит
3) эозинофильная гранулема.
Отек костного мозга.
Отек мозга визуализируется при 15 разных патологиях.
- Слева — отек при ревматоидном артрите
- В центре — отек при талассемии
- Справа -энхондрома
Остеоартроз.
1 стадия — субхондральный склероз — краевые костные разрастания 2 стадия субхондральные кисты (геоды)  выход на край — эрозии сужение суставной щели 3 стадия -дефигурация суставный поверхностей, нарушение взаимоотношения в суставе — хондромаляция, субхондральный отек (МРТ) — выпот в суставе (реактивный синовиит, МРТ)
— вакуум-феномен (кт)
Геоды встречаются при: — остеоартрозы - ревматоидный артрит (так же эрозии)  — болезни с нарушением отложения кальция (пирофосфатная артропатия, хондрокальциноз, гиперпаратиреоидизм)
— аваскулярный некроз
Геоды. Эрозии.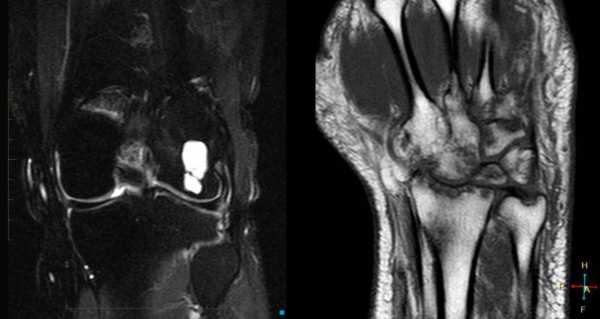
Гиперпаратиреоз.
• поднадкостничная резорбция в трубчатых костях кистей (лучевая часть), шейке бедренной кости, проксимальный отдел большеберцовой кости, ребрах • туннелирование кортикального слоя • опухоль Брауна (бурые опухоли) – литическое поражение с четкими ровными краями, раздувает надкостницу, м.б. кровоизлияние (кости таза, ребра, бедренная кость, кости лица). Чаще у женщин, возраст 30-60 лет. Развиваются У 20 % больных гиперапаратиреозом. Гетерогенный сигнал во последовательности на МРТ
• хондрокальциноз

Опухоль Брауна при гиперпаратиреозе
Возрастное распределение костных образований.
Локализация костных образований FD- фиброзная дисплазия Ewing – саркома Юинга EG- эфозиноф.гранулема Osteoidosteoma- остеоид- остеома NOF – не оссифицир. Фиброма SBC – простая костная киста CMF – хондромиксоидная фиброма ABC – анеривзматическая костная киста Osteosarcoma – остеогенная саркома Chondroblastoma – хондробластома Osteohondroma – остеохондрома Enchondroma-энхондрома Chondrosarcoma – хондросаркома Infection — инфекция Geode (геоды) – субхондральная киста Giant CT (GCT) – гигантоклеточная опухоль Metastasis – метастаз Myeloma –миелома Lymphoma – лимфома HPT- гиперпаратиреоидизм

Расположение.
• Центральное: простая костная киста, аневризматическая костная киста, эозинофильная гранулема, фиброзная дисплазия, энхондрома. • Эксцентричное: остеосаркома, неоссифицирующая фиброма,хондробластома, хондромиксоидная фиьрома, остеобластома, гиганоклеточные опухоли. • Кортикальное: остеоид-остеома.
• Юкстакортикальное : остеохондрома, парадоксальная остеосаркома
Принцип оценки рентгенографии.
Отношение возраста и наиболее частой патологии.
FD- фиброзная дисплазия Ewing – саркома Юинга EG- эфозиноф.гранулема Osteoidosteoma- остеоид-остеома NOF – не оссифицир. Фиброма SBC – простая костная киста CMF – хондромиксоидная фиброма ABC – анеривзматическая костная киста Osteosarcoma – остеогенная саркома Chondroblastoma –хондробластома Osteohondroma – остеохондрома Enchondroma-энхондрома Chondrosarcoma – хондросаркома Infection — инфекция Geode (геоды) – субхондральная киста Giant CT (GCT) – гигантоклеточная опухоль Metastasis – метастаз Myeloma –миелома Lymphoma – лимфома HPT- гиперпаратиреоидизм Leukemia — лейкемия Bone island –костные островки Low grade – низкодифференцированная High grade — высокодиффернцированная Parosteal Osteosar – параостальная остеосаркома

Ключевые моменты дифференциальной диагностики.
• Основная масса костных опухолей — остеолитические. • У пациентов до 30 лет наличие зон роста является нормой • Метастазы и миеломная болезнь всегда включаются в дифференциальный ряд множественного литического поражения у поражения у пациентов старше 40 лет • Остемиелит (инфекция) и эозинофильная гранулемы могут симулировать злокачественную опухоль (агрессивный тип периостальной реакции, деструкция кортикальной пластинки, плохое дифференцирование краев) • Злокачественные опухоли не могут вызывать доброкачественной периостальной реакции
• Наличие периостальной реакции исключает фиброзную дисплазию, энхондрому, неоссифицирующую фиброму, простую костную кисту.

Локализация опухолей костей.
FD-фиброзная дисплазия Ewing – саркома Юинга EG- эфозиноф. гранулема Osteoidosteoma- остеоид-остеома NOF – не оссифицир. Фиброма SBC – простая костная киста CMF – хондромиксоидная фиброма ABC – анеривзматическая костная киста Osteosarcoma – остеогенная саркома Chondroblastoma –хондробластома Osteohondroma – остеохондрома Enchondroma-энхондрома Chondrosarcoma – хондросаркома Infection — инфекция Geode (геоды) – субхондральная киста Giant CT (GCT) – гигантоклеточная опухоль Metastasis – метастаз Myeloma –миелома Lymphoma – лимфома HPT- гиперпаратиреоидизм Leukemia — лейкемия Bone island –костные островки Low grade – низкодифференцированная High grade — высокодиффернцированная Parosteal Osteosar – параостальная
остеосаркома

Специфическая локализация ряда костных образований.
Образования с множественными литическими изменениями по типу «изъеденных молью»
Изменения, которые могут формировать секвестр
Образования с множественными литическими изменениями по типу «мыльных пузырей»
Наиболее частые спинальные литические поражения.
1- гемангиома 2- метастаз 3- множественная миелома
4 — плазмоцитома

Другие варианты спинальных литических поражений.
Болезнь Педжета.
Болезнь Беджета (БП) является довольно распространенным заболеванием во многих европейских странах, США. Оценка распространенности у людей старше 55 лет колебалась от 2% до 5%. Факт, что значительная доля пациентов остаются бессимптомными на протяжении всей их жизни. БП всегда следует рассматривать в дифференциальной диагностике остеосклеротических, а также остеолитических скелетных поражений. I стадия (литическя) — острая стадия, определяется деструкция кортикального слоя в виде очагов пламени или в форме клина. II стадия (переходная) – смешанное поражение (остеолиз + склероз). III стадия (склеротическая) – преобладание склероза с возможной деформацией кости
В монооссальных случаях, частота которых, согласно публикациям, начинается от 10-20% доходя до почти 50%, дифференциальный диагноз может быть гораздо сложнее. В огромном большинстве случаев БП, наличие неоднородных участков костного склероза или остеолиза с искажением трабекулярной архитектуры в сочетании с кортикальным утолщением и фокальным утолщением кости практически патогномоничен для данного заболевания. Бедренная кость является второй наиболее распространенной монооссальной локализацией после таза. В случаях, когда имеется ее дистальное поражение, рентгенологические признаки, характерные для БП, выявляются с меньшей частотой или менее выражены, так что дифференциация с другими процессами, в частности, опухолевыми, может быть затруднена.
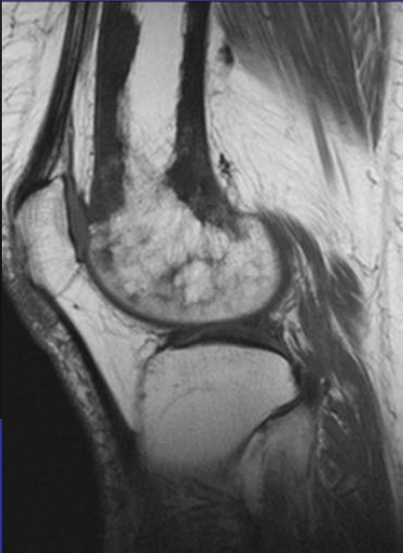
Аневризматические костные кисты.
• Интрамедуллярное эксцентричное метаэпизеальное многокамерное кистозное образование • В полостях определяются множественные уровни жидкости содержащие кровь • Ограничены мембраной различной толщины, состоящие из костных трабекул и остеокластов • В 70% — первичные, без явных причин • В 30% — вторичные, в результате травмы • Этиология неизвестна, предполагается неопластическая природа • Половой предрасположенности нет, в любом возрасте • Чаще располагаются в длинных трубчатых костях и позвоночнике Аневризматические костные кисты • Многокамерные кисты с перегородками • Множественные уровни жидкости • Склеротическое кольцо по периферии • При локализации в позвонках – поражает более одного сегмента • Редко располагается центрально «Раздувает» кость, вызывает деструкцию костных балок, компактного вещества
• Может распространяться на соседние костные элементы
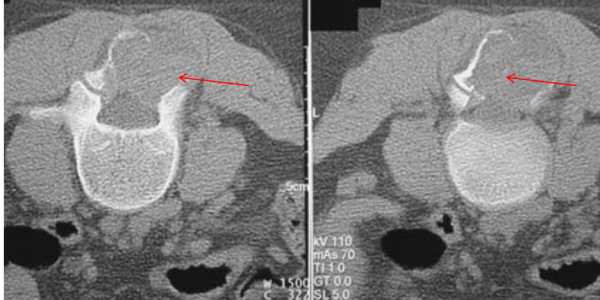
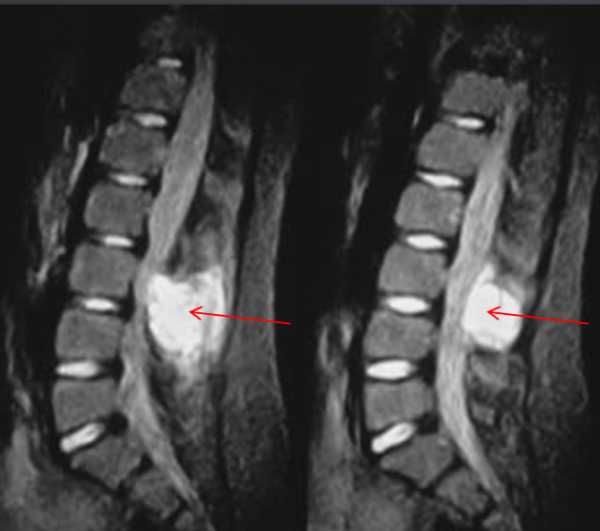 Еще один случай АКК
Еще один случай АКК
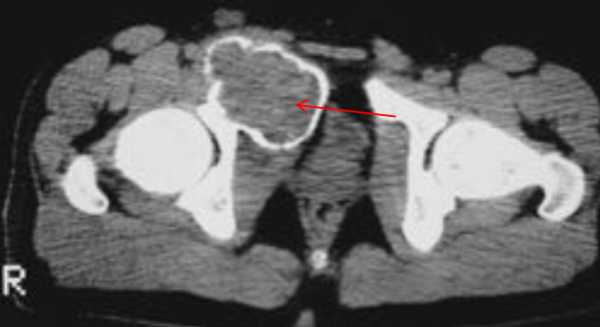
Простая костная киста.
Интрамедуллярные, чаще односторонние полости, с серозным или серозно-геморрагическим содержимым, отделены мембраной различной толщины • Чаще встречаются у мужчин (2/3:1) Обнаруживаются на первых двух декадах жизни у 80 % • В 50 % — проксимальная половина плечевой кости • В 25 % — проксимальная половина бедренной кости • Третья локализация по частоте встречаемости – проксимальная половина малоберцовой кости • У пожилых пациентов чаще встречается в таранной и пяточной костях  • Хорошо отграниченные, симметричные • Не распространяются выше эпифизиальной пластинки • Располагается в метаэпифизе, с ростом в диафиз Деформируют и истончают компактную пластинку • Периостальная реакция отсутствует • Возможны переломы, на фоне кист • Септ практически не содержат
• На T2W, stir, PDFS высокий однородный сигнал, низкий на T1W, без солидного компонента. Признаки высокобелкового компонента (кровь, повышение сигнала на T1W) возможно при переломах
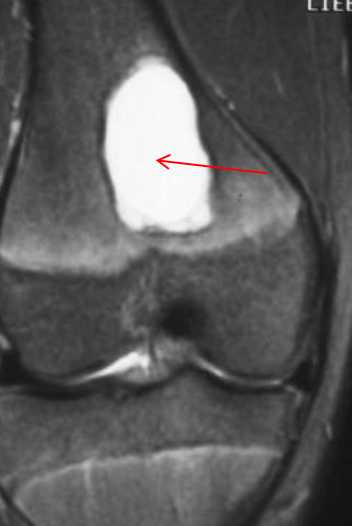
Юкстаартикулярная костная киста.
• Ненеоплатическое субхондральное кистозное образование, развивается в результате мукоидной дегенерации соединительной ткани • Не связно с дистрофическими процессами • Содержит муцинозную жидкость и отграничена фиброзной тканью с миксоидными имениями • Если в суставе определяются дистрофические изменения, это изменение трактуется как дегенеративнная субхондральная псевдокиста (чаще носят множественны характер) • Преобладают мужчины • 80% — между 30 и 60 годами
• Чаще располагается в тазобедренном, коленном суставах, голеностопных, лучезапястных и плечевых
Юкстаартикулярная костная киста • Определяется в виде хорошо отграниченного овального или округлого кистозного образования • Эксцентрично • Располагается субхондрально, в эпифизах • Ограничены соединительнотканной мембраной с фибробластами, коллагеном, синовиальными клетками • Синонимы – внутрикостный ганглион, внутрикостная мукоидная киста. • Могут деформировать надкостницу • Отграничены склеротическим ободком • Чаще1-2см,редкодо5см
• Дистрофические изменения в суставе не выражены
- Однородный низкий сигнал на T1W, высокий на T2W
- Низкий сигнал во все последовательности в склеротическом ободке
- Может быть отек (высокий сигнал на stir) в прилежащем костном мозге
• Синоним – неоссифицирующая фиброма (не путать с фиброзной дсиплазией), применяется для образований более 3 см • Ненеоплатическое образование • Состоит из фиброзной ткани с многоядерными гигантскими клетками, гемосидерином, воспалительными элементами, гистиоцитами с жировой тканью • Одно из самых частых опухолеподобных образований костной ткани • 60% — мужчины, 40% — женщины • 67% — на второй декаде жизни, 20% — на первой
• Наиболее часто поражает дистальный метаэпифиз бедренной кости и проксимальный метаэпифиз большеберцовой кости. Составляют 80 % случаев
• Длинник располагается вдоль оси кости • 2-4см, редко до 7 см и более • Кистозное образование в метаэпифизе, всегда вплотную прилежит к эндостальной поверхности компактной пластинки, часто по периферии склероз, четко отграничена от окружающего костного мозга • Может вызывать деструкцию кортикальной пластинки, осложняться переломом • Шире в дистальной части • Роста через метаэпифизиальную пластинку нет, распространяется по направления к диафизу • Могут быть геморрагические изменения • Нет периостальной реакции, изменений со стороны прилежащих мягких тканей
• Сниженный сигнал на T1W, вариабельный на T2W, stir чаще — высокий
Периостальный десмоид.
• Вариант фиброзного кортикального дефекта, локализующийся по дорзальной поверхности дистальной трети бедренной кости • Семиотика аналогичная фиброзному кортикальному дефекту,толькопроцессограничен кортикальный пластинкой
Фиброзная дисплазия.
• Доброкачественное интрамедуллярное фиброзно-костное диспластическое приобретенное образование • Может быть моно- и полиоссальное поражение • Монооссльаная форма – 75%
• Немного преобладают женщины (Ж-54%, М-46%)
• Возрастные характеристики представлены на следующем слайде • У 3% пациентов с полиоссальной формой развивается синдром McCune-Albright (пятна цвета «кофе с молоком» + эндокринные нарушения, наиболее часто – гонадотропнозависимое преждевременное половое созревание) Локализация Длинные трубчатые кости – проксимальная треть бедра, плечевая кость,большеберцовая кость • Плоские кости — ребра, челюстно-лицевая область — верхняя и нижняя челюсть • В трубчатых костях локализуется в метаэпифзах и диафизах При открытых зонах роста – локализация в эпифизах редкость • Гистологически состоит из фибробластов, плотног о коллагена, богато васкуляризированного матрикса, присутствуют костные трабекулы, незрелые остеоиды, остеобласты
• Возможны патологические переломы, перпендикулярно длинной оси
Патогномоничным признаком является картина «матового стекла» по данным КТ и рентгенографии, реже может наблюдаться картина литических изменений, в зависимости от степени преобладания фиброзного компонента • Экспансивный рост • Четкие контуры • Высокие цифры плотности, в сравнении с губчатым веществом, но меньше, чем у компактного • Деформирует, «раздувает » кость • В трубчатых костях формируется деформация по типу «посоха пастуха» • Периостальная реакция, мягкотканый компонент не выражены, деструкции кортикальной пластинки не определяется Могут формироваться массы с экспансивным ростом • Редко хрящевый компонент • Высокий сигнал на T2W, симптом «матового стекла» определяется как легко минерализованное образование. КТ картина более специфична и показательна • На МРТ могут определяться кисты, четко отграниченные, гомогенно высокий сигнал на T2W
• Фестончатый край внутренней поверхности кортикальной пластинки
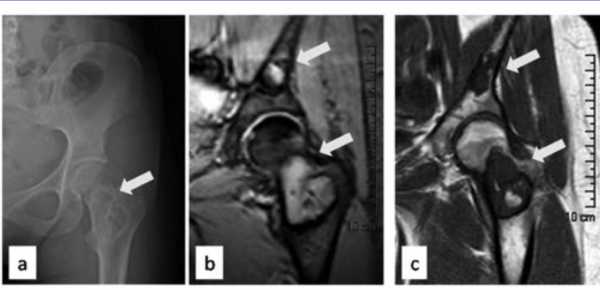
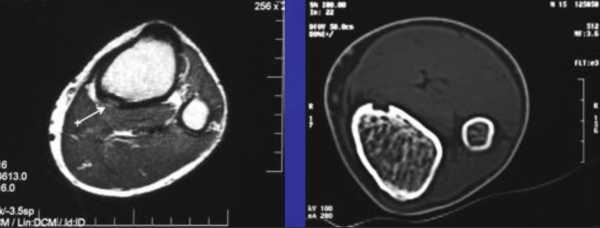
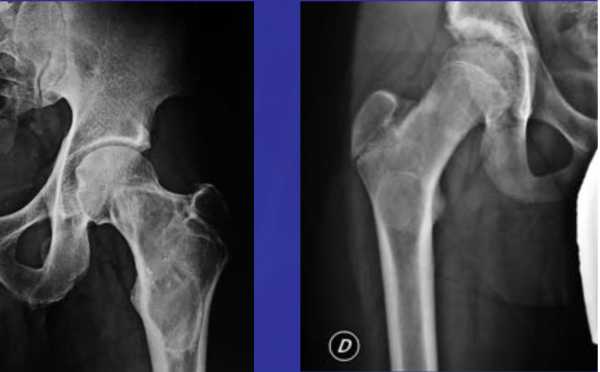
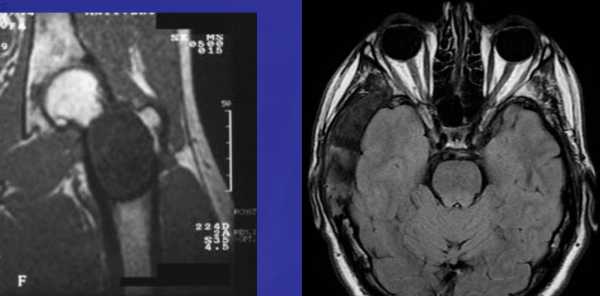
Остеофиброзная дисплазия.
• Доброкачественное фиброзно-костное образование • Синоним – оссифицирующая фиброма • Чаще у детей, преобладают мальчики • Первые две декады жизни • Наиболее частая локализация -передняя кортикальная пластинка большеберцовой, реже малоберцовой костей
• Представляет собой мультифокальное кистозного образование, основной массой, ограниченное передней кортикальной пластинкой и склерозом по периферии
• Деформирует, раздувает кость кпереди и по бокам • Высокий сигнал на T2W, низкий на T1W • Периостальной реакции нет
• В отличие от фиброзной дисплазии – экстрамедуллярное, кортикальное образование

Оссифицирующий миозит (гетеротопическая оссификация).
Редкое, доброкачественное образование • Локальное, четко-отграниченное, фиброзно-костное • Локализуется в мышцах или других мягких тканях, сухожилиях • Преобладают мужчины • Могут встречаться в любом возрасте, преобладает подростковый или молодой возраст • Чаще вовлекается нижняя конечность (четырехглавая и ягодичная мышцы) • На ранней стадии определяется уплотнение мягких тканей • С 4 по 6 недели – клочкообразная кальцинация по типу «вуали» • Кортикальная пластинка не вовлекается Инвазии костного мозга нет • Периостальной реакции нет, при близком расположении может казаться ложная принадлежность к кости • К 3-4 месяцу минерализуется, менее выраженная минерализация в центре, часто наблюдается периферическая кальцинация, по типу скорлупы, или может сохраняться глыбчатая кальцинация. • На МРТ в виде негомогенной массы (высокий сигнал на T2W, stir, низкий на T1W) участки низкого сигнала на T1W, T2W, PDFS за счет кальцинации, для точной визуализации лучше выполнять T2* (GRE) • Хрящевой ткани не содержит, что хорошо видно по T2* и PDFS
• КТ более информативна
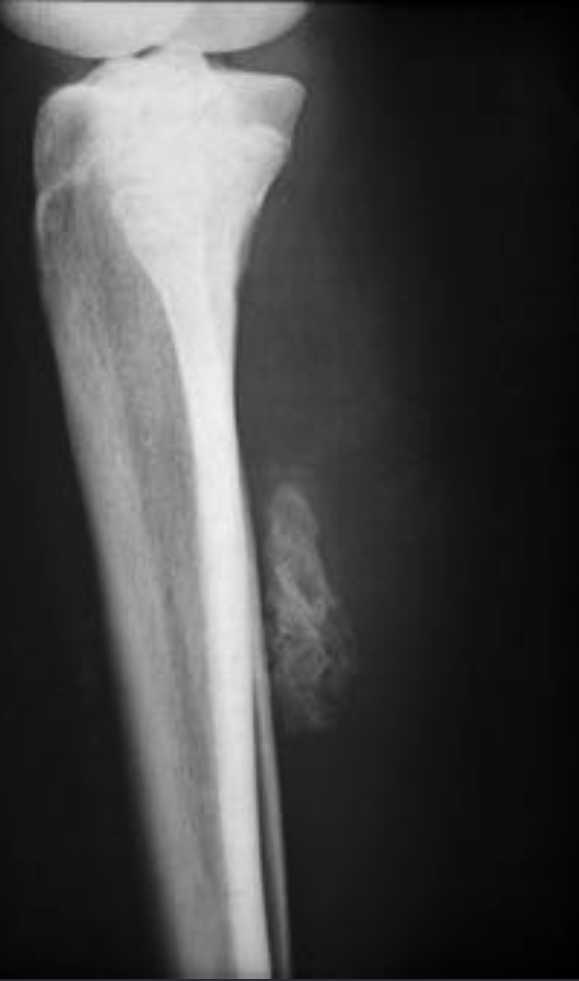
Лангергансноклеточный гистиоцитоз.
Формы: — эозинофильная гранулема — Hand–Schuller–Christian заболевание (диссеминированная форма) — Letterer–Siwe disease заболевание (диссеминированная форма) Этиология неизвестна. Менее 1% от всех образований костей. Чаще монооссальная форма, чем полиоссальная. Может быть в любом возрасте, чаще встречается у детей. Свод черепа, нижняя челюсть, позвонки, долинные кости нижних конечностей – редко.
Ребра — чаще поражаются у взрослых
«отверстие в отверстии» — плоские кости (свод черепа), склероз по периферии — «vertebra plana» — при поражении длинных трубчатых костей- литическое интрамедуллярное поражение в метаэпифизе илидиафизе — может быть кортикальная деструкция, периостальная реакция — очень редко уровень жидкости
— низкий сигнал на T1W, высокий на T2W, stir, накапливают КВ
Метастазы рак молочной железы
Остеоид остеома
1. Дифференциальная диагностика в костно-суставной патологии сложна и объемна. 2. Целесообразно и оправданно применять муль тимодальный подход, с использованием данных рентгенографии, КТ, МРТ, УЗ-диагностики 3. Необходимо учитывать данные лабораторных методов исследования и клиническую картину при выстраивании дифференциального ряда.
4. Неукоснительно соблюдать методику и полностью использовать все возможности методов лучевой диагностики (полипозиционная, сравнительная рентгенография, костный режим при КТ ОБП, DWI последовательности при любом очаговом процессе и т.д)
Материал взят из лекции:
- Вопросы дифференциальной диагностики костно-суставной патологии. Что должен знать рентгенолог? Екатеринбург 2015
- Мешков А.В. Цориев А.Э.
24radiology.ru
Кортикальный дефект бедренной кости: симптомы, лечение и прогноз
Причины образования патологии на сегодняшний день остаются не до конца изученными. Выявлена некоторая связь с генетически обусловленными системными заболеваниями соединительной ткани, в частности, крупные очаги поражения часто сопутствуют нейрофиброматозу I типа, фиброзной дисплазии, синдрому Яффе-Кампаначчи. Также отдельные исследования выявляют связь развития кортикального фиброзного дефекта с гипофосфатемическим витамин Д-резистентным рахитом.
В большинстве случаев этиология заболевания остается неясной. Патология выявляется случайно при рентгенологическом обследовании. Дефект нельзя отнести к редким: согласно статистике, у 30-40% детей в возрасте от 3 до 10 лет выявляются фиброзные очаги в метафизе и диафизе большеберцовой кости. Мальчики подвержены заболеванию вдвое чаще, чем девочки. У взрослых после закрытия ростковых зон костей фиброзный дефект не развивается. Как правило, к 13-14 годам наблюдается ремиссия патологии, и очаги фиброзной ткани замещаются нормальной костной тканью.
Случаев озлокачествления фиброзных новообразований в медицинской литературе не описано.
Клиническая картина
Фиброзный кортикальный дефект обнаруживается чаще всего в метафизе и диафизе большеберцовых костей, в местах прикрепления активных мышц, и представляет собой опухолеподобное очаговое перерождение тканей. Очаги представлены волокнистой фиброзной тканью с включениями гигантских клеток, а в некоторых случаях – рассеянных в фиброзной ткани веретенообразных и ксантомных клеток: нагруженных холестериновым эфиром макрофагов, перерожденных моноцитов. Также внутри фиброзных очагов могут быть обнаружены лимфоциты и плазменные клетки как следы воспалительной реакции.
Очаги чаще всего возникают первично на периостальной поверхности, с течением времени распространяются интра- и субкортикально. В редких случаях новообразование заполняет весь поперечник кости. Если очаги имеют склонность к быстрому росту и распространению, заболевание классифицируют как неоссифицирующую фиброму и причисляют к доброкачественным новообразованиям, подлежащим оперативному лечению.
Отмечались ситуации, когда у пациента в кости одной конечности наблюдался фиброзный кортикальный дефект, а в другой – неоссифицирующая фиброма, что позволяет высказать предположение об общей природе их возникновения. При дифференциации фиброзного кортикального дефекта от неоссифицирующей фибромы принимают во внимание степень вовлечения в патологию костномозгового канала: ФКД не затрагивает его, а неоссифицируущая фиброма имеет тенденцию к прорастанию внутрь канала.
В отличие от кортикального дефекта, не выявляемого при прощупывании, фиброма может проявлять себя как припухлость плотной консистенции, неподвижная, не спаянная с кожей, слегка болезненная при пальпации.
При наличии фиброзного дефекта большеберцовой кости и при неоссифицируемой фиброме общее состояние больного остается удовлетворительным. Клинические анализы крови не позволяют выявить никаких характерных особенностей данных состояний.
Стоит отметить, что в медицинских кругах нет единого мнения о дифференциации ФКД и неоссифицирующей фибромы. Ряд специалистов считают их двумя разновидностями течения одной патологии, другие относят фиброму к опухолевым заболеваниям костной ткани, а ФКД не патологией, а дефектом или особенностью развития и роста костной ткани. Существует также мнение, что ФКД и неоссифицирующая фиброма являются разными стадиями течения одного заболевания.
Патология развивается бессимптомно и не сопровождается болевыми ощущениями или нарушениями подвижности конечностей. Однако в случаях масштабного замещения костной ткани фиброзной существенно снижается прочность кости, что может привести к патологическим переломам.
Диагностика кортикального дефекта
На рентгенологическом снимке обнаруживаются светлые очаги с четко очерченными границами склерозированной ткани, также наблюдается вздутие кортикального слоя. В случае неоссифицирующей фибромы в патологический процесс включен костномозговой канал.
Сцинтография при диагностике кортикального дефекта в большинстве случаев оказывается неэффективной и не позволяет выявить патологию. В отдельных случаях наблюдаются очаги умеренного поглощения и умеренной гиперемии. При обнаружении выраженного поглощения и гиперемии можно заподозрить перелом.
Патологию следует дифференцировать от других опухолевых образований костной ткани.
- Доброкачественная фиброзная гистоцитома отличается от фиброзного кортикального дефекта тем, что на рентгенографическом снимке не выявляется. Также фиброзная гистоцитома может вызывать болезненные ощущения.
- Фиброзная дисплазия имеет везикулярную форму, развивается от центра кости.
- Периостальный десмоид выявляется в значительно более позднем возрасте – от 12 до 20 лет.
Процесс заживления очагов фиброзной ткани на рентгенографическом снимке следует отличать от процесса злокачественной резорбции тканей.
Новообразования
Большая часть дефектов костей вызвана этой категорией заболеваний.
Дефекты костей доброкачественного происхождения встречаются довольно часто и обычно обнаруживаются случайно при рентгенологическом исследовании по поводу травмы.
Такие дефекты обычно протекают бессимптомно и имеют довольно характерную локализацию.
Злокачественные дефекты костей могут быть первичными или вторичными. Вторичное поражение кости опухолью встречается гораздо чаще, чем первичная опухоль костей. Ниже описаны наиболее типичные проявления некоторых из этих опухолей.
Фиброзный дефект кортикального слоя
Фиброзный дефект кортикального слоя (рис. 124). Это один из вариантов нормы, представляющий собой участок остеолиза, рентгенологическое изображение которого настолько характерно, что для подтверждения диагноза не требуется никаких дополнительных диагностических методов.
Рис. 124. Аксиальная рентгенограмма проксимального отдела большеберцовой кости ребенка 9 лет.
Обнаруживаются типичные фиброзные дефекты кортикального слоя.
Чаще всего он встречается у детей в возрасте от 4 до 8 лет, для него характерна спонтанная регрессия. Дефект встречается чаще у мальчиков, чем у девочек, и протекает бессимптомно.
Чаще всего он встречается в заднемедиальном участке дистального отдела бедренной кости, хотя может наблюдаться и в берцовых костях. Рентгенологически обнаруживается маленькое круглое, яйцевидное или неправильной формы просветление сразу у кортикальной пластинки кости. Края его плотно склерозированы, хорошо очерчены и никогда не проникают через кортикальную пластинку.
Доброкачественная хондробластома
Доброкачественная хондробластома (рис. 125). Эта опухоль встречается относительно редко, предположительной причиной ее считают рост хондробластов. Чаще она встречается в возрасте от 10 до 25 лет и приблизительно в 50% случаев, поражает коленный сустав.
Рис. 125. Рентгенограмма дистального отдела бедренной кости мальчика 14 лет. Обнаруживаются четко отграниченные участки остеолизиса в области эпифиза (стрелки). При биопсии
этих участков обнаружена хондробластома.
Описаны необычные случаи локализации доброкачественной хондробластомы, например, надколенник. Она может также встречаться в любой плоской кости, которая образовалась из хрящевой основы.
К основным проявлениям заболевания относятся жалобы на боли в суставах. Описаны жалобы на болезненность, отечность, ограничение движения, слабость, онемение в области сустава, местный жар и мышечную атрофию.
Почти всегда дефект наблюдается в области эпифиза. Как правило, у больных молодого возраста прежде всего при обнаружении участка остеолиза следует предположить именно этот диагноз. Края дефекта обычно тонкие и склеротические, имеют «неагрессивный» вид.
Размер дефекта колеблется от 3 до 19 см, может наблюдаться эксцентрическое яйцевидное выбухание кортикального слоя; заболевание не сопровождается отчетливой реакцией надкостницы. Приблизительно у 50% таких опухолей, субстрат дефекта представлен в виде аморфной «рыхлой ваты».
Заболевание дифференцируют с довольно редким абсцессом Броди, поражающим только эпифиз, с еще более редкой эозинофильной гранулемой эпифиза и с гигантоклеточной опухолью. Правда, вид гигантоклеточной опухоли более «агрессивный».
Однокамерная киста кости
Однокамерная (простая) киста кости (см. рис. 114). Это доброкачественное заболевание костей неизвестной этиологии представляет собой истинную кисту, заполненную жидкостью. Приблизительно 80% таких дефектов наблюдается у детей в возрасте от 3 до 14 лет, чаще у мальчиков.
У больных младше 17 лет обычно этим заболеванием поражаются проксимальные отделы плечевой и бедренностей костей, а у больных старше 17 лет — кости таза и пяточная кость.
Рентгенологические симптомы однокамерной кисты кости очень характерны. Они обычно представлены в виде центрального метафизарного дефекта с «неагрессивными» краями вблизи эпифизарной пластинки или примыкающего к ней.
Границы дефекта обычно шире в области метафиза и уже в области диафиза, таким образом, длинная ось его больше, чем диаметр. Ширина дефекта редко превышает ширину эпифизарной пластинки, такая киста никогда не распространяется в мягкие ткани.
Интересно, что обычно это нарушение проявляется в виде патологического перелома. В этих случаях фрагмент кости может западать в нижележащую часть рентгеноконтрастной опухоли (киста) — симптом «упавшего фрагмента». Простую кисту кости дифференцируют с гигантоклеточной опухолью, аневризматической кистой, энхондромой, хондромиксоидной фибромой.
Хондромиксоидная фиброма и аневризматическая киста костей обычно располагаются более эксцентрично и локализация их более разнообразна. В полости энхондром обычно отмечается точечная кальцификация хряща, а гигантоклеточные опухоли выглядят, как правило, более агрессивно.
Лечение простой кисты обычно заключается в хирургическом кюретаже. Описана склонность к рецидивированию.
Эпидемиология метафизарного фиброзного дефекта кости
Метафизарный фиброзный дефект кости обнаруживается почти исключительно в метафизах длинных трубчатых костей у детей и подростков при рентгенографии, выполненной часто без всяких предшествующих жалоб по разным поводам (травма или для сравнения при жалобах со стороны противоположного сустава).
Гистология и патогенез метафизарного фиброзного дефекта кости
Метафизарный фиброзный дефект кости (другие названия: фиброзный корковый дефект, неоссифицирующая фиброма, кортикальная лакуна) — явно неопухолевый дефект костной ткани. Такие новообразования встречаются очень часто, могут протекать бессимптомно и бывают случайной находкой при рентгенологическом исследовании. Морфологически эти очаги состоят из волокнистой соединительной ткани с фибробластами и рассеянными гигантскими клетками, в части случаев, особенно при длительно существующих очагах, содержат примесь ксантомных клеток.
Читайте также: Как снять отек после перелома: практические рекомендацииХарактер метафизарного фиброзного дефекта кости не соответствует представлениям об опухолях и позволяет рассматривать эти находки как очаговую перестройку костной ткани, начинающуюся с резорбции и завершающуюся ее воссозданием. Причина такой перестройки не выяснена. Метафизарный фиброзный дефект кости в 90% случаев возникает в метафизах длинных костей, чаще всего нижних конечностей. Они начинаются на периостальной поверхности и, увеличиваясь в размерах, смещаются интракортикально, а затем субкортикально, сохраняя эксцентрическое положение даже при значительных размерах. Только в более тонких костях (малоберцовой) они могут занимать весь поперечник.
В некоторых случаях очаги с такой гистологической картиной достигают больших размеров, продолжают увеличиваться при динамическом наблюдении. При этом они могут потребовать более активной тактики вплоть до хирургической резекции. Очаги с такими особенностями расценивают как опухоли — неоссифицирующие фибромы.
Противопоставление неоссифицирующих фибром как опухолей типичным МФД как неопухолевым поражениям нельзя считать оправданным, учитывая одинаковую гистологическую картину и тот факт, что во всех таких очагах может восстанавливаться нормальная костная структура.
Озлокачествление метафизарного фиброзного дефекта кости и неоссифицирующих фибром не описано.
Некоторые авторы выделяют фиброзную гистиоцитому, которая гистологически идентична неоссифицирующей фиброме.
Симптомы и лучевая диагностика метафизарного фиброзного дефекта кости
Патология
Неоссифицирующая фиброма макроскопически представляет собой мясистое, волокнистое, желтое или коричнево-коричневое поражение с участками кровоизлияния [3].Микроскопически поражение характеризуется высокой клеточностью, с наличием веретеновидных клеток, на фоне стромы, формируя так называемый «муаровый» узор. Встречаются пенистые гистиоцит и многоядерные гигантские клетки. Митотические фигуры и /или дисплазия не характерны для фиброксантомы [3]. Считается, что костные островки являются самоизлечившимися фиброксантомами.
Рентгенография /Компьютерная томография
Неоссифицирующая фиброма характеризуется дольчатой формой, обычно имеет склеротический ободок. Локализуются эксцентрично, в прилежащем к ростовой пластинке метафизе. С ростом пациента, смещается и отдаляется от ростовой пластинки. Не сочетается с периостальной реакцией, нарушением целостности кортикальной пластинки и не имеет мягкоткпнного компонента.
Магнитно-резонансная томография
МР картина разнообразная и зависит отдлительности заболевания и репаративной фазы, при которой получены изображения. В начале заболевания, поражение характеризуется высоким или промежуточным сигналом на Т2 взвешенных изображениях, окружённым по периферии низкоинтенсивным ободком, отражающем склеротическую границу. С началом оссификации сигнал становится низкоинтенсивным на всех последовательностях [2]. Контрастное усиление варьирует.
Сцинтиграфия
Данные сцинтиграфии зависят от фазы поражения. В целом они отрицательны; однако, во время процессов репарации присутсвуют умеренная гиперемия и умеренное поглащение. Если имеется выраженное поглощение или гиперемия, следует рассмотреть альтернативный диагноз или заподозрить перелом [3].
Лечение и прогноз
Неоссифицирующая фиброма относится к категории поражений “не трогай и оставь меня в покое“. В подавляющем большинстве случаев не требует биопсии и лечения. При вовлечении в процесс более половины диаметра кости, с целью профилактики патологического перелома, выполняется кюретаж с графитнгом/замещением кости [1].
- https://NogoStop.ru/bedro/fibroznyj-kortikalnyj-defekt-bedrennoj-kosti.html
- https://medbe.ru/materials/kostnaya-patologiya/osteoliz-dobrokachestvennye-i-zlokachestvennye-novoobrazovaniya/
- http://medprevention.ru/nogi/stupni-koleni-lodyzhki/1459-fibrozno-kortikalnyj-defekt-bolshebertsovoj-kosti-u-rebenka
- https://radiographia.info/article/nonossifying-fibroma
yazdorov.win