Лечение суставов - артроз, артрит, остеохондроз и многое другое
Катадолон при синдроме грушевидной мышцы
Катадолон - инструкция по применению, отзывы, аналоги и формы выпуска (капсулы 100 мг, таблетки 400 мг пролонгированные форте или ретард) лекарства для лечения и купирования боли у взрослых, детей и при беременности
В данной статье можно ознакомиться с инструкцией по применению лекарственного препарата Катадолон. Представлены отзывы посетителей сайта - потребителей данного лекарства, а также мнения врачей специалистов по использованию Катадолона в своей практике. Большая просьба активнее добавлять свои отзывы о препарате: помогло или не помогло лекарство избавиться от заболевания, какие наблюдались осложнения и побочные эффекты, возможно не заявленные производителем в аннотации. Аналоги Катадолона при наличии имеющихся структурных аналогов. Использование для лечения и купирования боли у взрослых, детей, а также при беременности и кормлении грудью.
Катадолон - анальгетик центрального действия. Является селективным активатором нейрональных калиевых каналов. Не относится к опиоидам, не вызывает зависимости и привыкания.
Оказывает анальгетическое, миорелаксирующее и нейропротекторное действие, основанное на непрямом антагонизме по отношению NMDA-рецепторам, активации нисходящих механизмов модуляции боли и GABA-ергических процессов.
В терапевтических концентрациях флупиртин не связывается с альфа1-, альфа2-адренорецепторами, серотониновыми 5HT1-, 5НТ2-рецепторами, допаминовыми, бензодиазепиновыми, опиоидными, центральными м- и н- холинорецепторами.
Антиспастическое действие на мышцы связано с блокированием передачи возбуждения на мотонейроны и промежуточные нейроны, приводящим к снятию мышечного напряжения. Это действие флупиртина проявляется при многих хронических заболеваниях, сопровождающихся болезненными мышечными спазмами (скелетно-мышечные боли в шее и спине, артропатии, головные боли напряжения, фибромиалгия).
Благодаря нейропротекторным свойствам защищает нервные структуры от токсического действия высоких концентраций ионов внутриклеточного кальция, что связано, со способностью флупиртина вызывать блокаду нейрональных ионных кальциевых каналов и снижать внутриклеточный ток ионов кальция.
Состав
Флупиртина малеат + вспомогательные вещества.
Фармакокинетика
После приема внутрь практически полностью (до 90%) и быстро всасывается из ЖКТ. Выводится в основном почками (69%): 27% выводится в неизмененном виде, 28% - в виде метаболита М1 (ацетил-метаболит), 12% - в виде метаболита М2 (пара-фторгиппуровая кислота) и остальная треть состоит из нескольких метаболитов с невыясненной структурой. Небольшая часть дозы выводится из организма с желчью и калом.
Показания
Острый и хронический болевой синдром при следующих заболеваниях и состояниях:
- мышечный спазм;
- злокачественные новообразования;
- первичная альгодисменорея;
- головная боль;
- посттравматические боли;
- дорсалгия;
- цервикалгия;
- миалгия;
- боли при травматологических/ортопедических операциях и вмешательствах.
Формы выпуска
Капсулы 100 мг.
Таблетки пролонгированного действия 400 мг форте или ретард.
Инструкция по применению и режим дозирования
Капсулы
Внутрь, не разжевывая и запивая небольшим количеством жидкости (100 мл).
Взрослым: по 1 капсуле 3-4 раза в день с равными интервалами между приемами. При выраженных болях - по 2 капсуле 3 раза в день. Максимальная суточная доза - 600 мг (6 капсул).
Дозы подбирают в зависимости от интенсивности боли и индивидуальной чувствительности больного к препарату.
Длительность терапии определяется лечащим врачом и зависит от динамики болевого синдрома и переносимости. При длительном применении следует контролировать активность печеночных ферментов с целью выявления ранних симптомов гепатотоксичности.
Таблетки
Внутрь, не разжевывая и запивая небольшим количеством жидкости (100 мл), по 1 таблетке 1 раз в день. Максимальная суточная доза - 400 мг.
Если боль продолжает беспокоить, необходимо рассмотреть вопрос о дополнительной терапии другими обезболивающими средствами. Длительность терапии определяется лечащим врачом и зависит от динамики болевого синдрома и переносимости.
Во время лечения необходимо регулярно контролировать активность печеночных ферментов в сыворотке крови и концентрацию креатинина в моче.
Побочное действие
- депрессия;
- нарушения сна;
- потливость;
- беспокойство;
- нервозность;
- тремор;
- головная боль;
- спутанность сознания;
- нарушения зрения;
- головокружение;
- изжога;
- тошнота, рвота;
- запор или диарея;
- метеоризм;
- боли в животе;
- сухость во рту;
- потеря аппетита;
- повышение температуры тела;
- крапивница;
- зуд.
Противопоказания
- печеночная недостаточность с явлениями энцефалопатии;
- холестаз;
- тяжелая миастения;
- хронический алкоголизм;
- беременность;
- детский и подростковый возраст до 18 лет;
- повышенная чувствительность к флупиртину.
Применение при беременности и кормлении грудью
Противопоказан к применению при беременности.
При необходимости применения в период лактации следует решить вопрос о прекращении грудного вскармливания на период лечения, т.к. показано, что незначительное количество флупиртина выделяется с грудным молоком.
Особые указания
С осторожностью применять при нарушениях функции печени и/или почек, пациентам старше 65 лет. Пациентам этих групп требуется коррекция режима дозирования.
Побочные эффекты в основном зависят от дозы. Во многих случаях они исчезают сами по себе по мере проведения терапии или после окончания лечения.
При лечении Катадолоном возможны ложноположительные результаты теста с диагностическими полосками на билирубин, уробилиноген и белок в моче. Аналогичная реакция возможна при количественном определении уровня билирубина в плазме крови.
При применении в высоких дозах в отдельных случаях может отмечаться окрашивание мочи в зеленый цвет, что не является клиническим признаком какой-либо патологии.
У пациентов с нарушениями функцией печени или почек следует контролировать активность печеночных ферментов и содержание креатинина в моче.
При одновременном применении Катадолона с препаратами, которые также метаболизируются в печени, требуется регулярный контроль активности печеночных ферментов.
Следует избегать комбинированного применения флупиртина и лекарственных средств, содержащих парацетамол и карбамазепин.
Влияние на способность к вождению автотранспорта и работе с механизмами
Учитывая, что флупиртин может ослаблять внимание и замедлять ответные реакции организма рекомендуется во время лечения препаратом воздерживаться от вождения транспорта и занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Лекарственное взаимодействие
Флупиртин усиливает действие седативных средств, миорелаксантов, а также этанола.
В связи с тем, что Катадолон связывается с белками плазмы крови, следует учитывать возможность его вытеснения из связи с белками другими одновременно принимаемыми лекарственными средствами. В тоже время показано, что флупиртин вытесняет варфарин и диазепам из связей с белками, что при одновременном приеме с флупиртином может привести к усилению их активности.
При одновременном применении флупиртина и производных кумарина возможно повышение антикоагулянтного действия.
Аналоги лекарственного препарата Катадолон
Структурные аналоги по действующему веществу:
Аналоги по оказываемому фармакологическому эффекту (средства для купирования боли):
- Аскафф;
- Бупранал;
- ДГК Континус;
- Дексалгин;
- Диклоберл;
- Димексид;
- Дипидолор;
- Долак;
- Дюрогезик;
- Залдиар;
- Кеталгин;
- Кетанов;
- Кетонал Дуо;
- Кеторол;
- Кеторолак;
- Лидокаин;
- Метиндол ретард;
- Метиндол;
- Морадол;
- Морфин;
- Нопан;
- Промедол;
- Просидол;
- Протрадон;
- Раптен Дуо;
- Рекофол;
- Скенан;
- Стадол;
- Тиаприд;
- Тиапридал;
- Торадол;
- Трамадол;
- Трамал;
- Трамолин;
- Трамундин ретард;
- Транстек;
- Фендивия;
- Фентанил;
- Фламакс форте;
- Фламакс;
- Флугалин.
instrukciya-otzyvy.ru
Синдром грушевидной мышцы: симптомы и лечение
Синдром грушевидной мышцы является одной из самых частых причин упорного болевого синдрома. Его признаки имеются более чем у половины пациентов с дорсопатиями пояснично-крестцового отдела. Но зачастую этот синдром остается своевременно не диагностированным, что существенно затягивает сроки лечения и приводит к назначению значительного количества разнообразных препаратов.
В чем суть синдрома
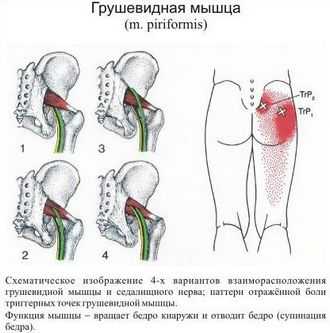
Синдром грушевидной мышцы относится к компрессионно-ишемическим туннельным невропатиям. Его ключевые проявления обусловлены сдавливанием ствола седалищного нерва и идущих с ним сосудов в так называемом подгрушевидном отверстии (пространстве). И в качестве основного фактора компрессии при этом выступает спазмированная и измененная грушевидная мышца.
Парное подгрушевидное отверстие располагается в ягодичной области и является нижней частью большого седалищного отверстия таза. Анатомически оно имеет щелевидную форму и ограничивается крестцово-бугристой связкой, нижним краем грушевидной мышцы (m. piriformis) и верхней близнецовой мышцей (m. gemellus superior). Через подгрушевидное отверстие из полости таза в глубокое ягодичное пространство выходят седалищный нерв, задний кожный нерв бедра, нижний ягодичный и срамной (половой) сосудисто-нервные пучки. Они имеют фасциальные футляры, но не способны противостоять внешней компрессии.
Патологическое стойкое сокращение грушевидной мышцы сопровождается утолщением ее брюшка, что приводит к существенному сужению подгрушевидного отверстия. Проходящие в нем сосуды и нервы при этом прижимаются к костной основе и крестцово-остистой связке, что и является причиной появления основных симптомов. При этом наибольшую клиническую значимость имеет компрессия ствола седалищного нерва. Именно невропатия и является причиной обращения пациентов к врачу.
Седалищный нерв может проходить и через толщу брюшка грушевидной мышцы. Его компрессия при таком нечасто встречающемся анатомическом варианте обычно не сочетается со cдавливанием других сосудисто-нервных пучков в подгрушевидном пространстве.
Этиология
Синдром грушевидной мышцы по механизму развития может быть первичным и вторичным, когда мышечно-тонический синдром возникает вследствие других патологических состояний. На долю вторичных нарушений приходится более 80% клинических случаев.
В качестве причины развития синдрома грушевидной мышцы могут выступать:
- Длительное сохранение нефизиологической позы с асимметричной перегрузкой тазово-подвздошной группы мышц. Это возможно при неправильно организованном рабочем месте, вынужденном положении конечностей и таза в случае их неграмотной фиксации после травм. Спазм грушевидной мышцы также часто развивается при анталгической позе в случае вертеброгенного корешкового синдрома.
- Травмы пояснично-крестцовой и тазовой областей, приводящие к растяжению или повреждению (надрыву) грушевидной мышцы или к формированию компрессирующей гематомы.
- Вертеброгенная патология (остеохондроз с поражением пояснично-крестцового отдела, опухоли позвоночника и паравертебральных структур, поясничный стеноз и другие пояснично-крестцовые дорсопатии). При этом спазм грушевидной мышцы является проявлением мышечно-тонического синдрома и может иметь рефлекторную или корешковую природу.
- Сакроилеит любой этиологии.
- Синдром скрученного и кососкрученного таза различного происхождения. Он может возникать при разной длине конечностей (в случае отсутствия достаточной ортопедической коррекции), S-образном сколиозе, патологии тазобедренных суставов.
- Перетренированность мышцы, развивающаяся вследствие нерациональных избыточных нагрузок на ягодичную мышечную группу и отсутствия периода отдыха между силовыми тренировками.
- Оссифицирующий миозит.
- Инфекционно-воспалительные заболевания органов малого таза, приводящие к рефлекторному спазму мышцы. Наиболее вероятная причина – гинекологическая патология.
К нечасто встречающимся причинам синдрома грушевидной мышцы относят технически неправильно проведенную внутримышечную инъекцию, переохлаждение.
Патогенез
Спазм мышцы сопровождается не только ее укорочением и утолщением, хотя именно это и приводит к сужению подгрушевидного отверстия с компрессией нервов и сосудов. Большое значение имеют и другие патологические изменения.
В патологически напряженной мышце возникают множественные микроповреждения волокон и накапливаются недоокисленные продукты обмена. В ответ на это начинают продуцироваться медиаторы воспаления, повышается проницаемость мелких сосудов, развивается асептическое воспаление и индурация тканей. В этот процесс нередко вовлекаются и мышцы тазового дна, что может усугубить болевой синдром и стать причиной легкой сфинктерной дисфункции.
Кроме того, медиаторы воспаления способствуют локальным изменениям в оболочке седалищного нерва, усиливая проявления его компрессионной невропатии.
Клиническая картина
Основным признаком синдрома грушевидной мышцы является стойкая и зачастую резистентная к лечению боль. Она имеет несколько патогенетических механизмов и обычно сочетается с другими клиническими проявлениями. При этом болевой синдром в 2/3 случаев дебютирует с люмбалгии (боли в пояснице), которая в течение 2 недель трансформируется в ишиалгию (боли, связанные с поражением седалищного нерва).
Синдром грушевидной мышцы складывается из нескольких групп симптомов:
- Локальные – связанные непосредственно со спазмом грушевидной мышцы. Их выявление позволяет провести дифференциальную диагностику между синдромом грушевидной мышцы и вертеброгенным болевым синдромом.
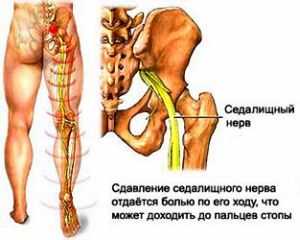
- Нейропатические – связанные с компрессией седалищного нерва. Сюда входят характерная ишиалгия, чувствительные, вегетативные и двигательные нарушения в нижней конечности на стороне спазма грушевидной мышцы.
- Сосудистые симптомы – обусловленные сдавливанием ягодичной артерии и других сосудов, проходящих в подгрушевидном отверстии.
Спазмированная мышца дает постоянную боль в ягодично-крестцовой области тянущего, ноющего, тягостного мозжащего характера. Некоторые пациенты в качестве места наибольшей болезненности указывают зоны крестцово-подвздошного сочленения и тазобедренного сустава, что может привести к неправильному диагностическому поиску. Ходьба, приведение бедра, попытка положить ногу на ногу, приседание на корточки сопровождаются усилением неприятных ощущений. А некоторому уменьшению боли способствует умеренное разведение ног в положении лежа или сидя. Но полностью избавиться от связанного со спазмом дискомфорта не удается.
Такая боль дополняется ишиалгией. При этом пациенты отмечают прострелы и постоянные мозжащие ощущения по задней поверхности бедра, сопровождающиеся чувством зябкости или жжения, ощущением онемения или одеревенения, ползанья мурашек. Боль из-за компрессии седалищного нерва может также локализоваться в зоне иннервации его основных ветвей – большеберцового или малоберцового нервов. При этом пациенты могут жаловаться на неприятные ощущения в голени и стопе, усиливающиеся при изменении погоды, ходьбе, в стрессовых ситуациях.
К двигательным проявлениям синдрома грушевидной мышцы относят парезы мышц голени и стопы. Их локализация и комбинация зависят от того, какие волокна седалищного нерва подверглись компрессии. При тяжелой нейропатии возможно даже появление «болтающейся», «конской» или «пяточной» стопы.
Сосудистый компонент синдрома грушевидной мышцы – это, в первую очередь, перемежающаяся хромота. Причем она связана не только с компрессией артерий в подгрушевидном пространстве, как полагали ранее. Основную роль в развитии такой преходящей ишемии играет спазм артерий среднего и мелкого калибра, обусловленный поражением постганглионарных симпатических волокон в составе седалищного нерва. Кроме перемежающейся хромоты, появляется онемение и похолодание пальцев на стопе, побледнение кожи ноги.
Возможны и дополнительные симптомы, например, дисфункция сфинктеров уретры и прямой кишки. Она связана с вторичным спазмом мышц тазового дна. При этом появляются паузы перед началом мочеиспускания, неприятные ощущения при дефекации, диспареуния (дискомфорт и боль в гениталиях при половом акте).
Диагностика
 Обследуя пациента, врач проводит ряд тестов, позволяющих заподозрить синдром грушевидной мышцы.
Обследуя пациента, врач проводит ряд тестов, позволяющих заподозрить синдром грушевидной мышцы.Диагностика синдрома грушевидной мышцы складывается из данных физикального осмотра и результатов дополнительных инструментальных методов исследования.
Ключевыми признаками этого синдрома являются:
- Определяемая пальпаторно под толщей ягодичных мышц болезненная, плотная, тяжеобразная грушевидная мышца. Ее состояние может быть оценено также при трансректальном исследовании.
- Болезненность в зонах прикрепления грушевидной мышцы – по верхневнутренней области большого вертела и нижней части крестцово-подвздошного сочленения.
- Положительный симптом Фрайберга – появление боли при вращении вовнутрь согнутого бедра.
- Положительный симптом Битти (Беатти) – появление боли при попытке поднять колено, лежа на здоровом боку.
- Положительный симптом Пейса – болезненность при сгибании, аддукции и внутренней ротации бедра. Его называют также САВР-тестом.
- Положительный тест Миркина, для проведения которого пациента просят медленно наклоняться вперед из положения стоя без сгибания коленей. Надавливание на ягодицу в зоне проекции выхода седалищного нерва из-под грушевидной мышцы приводит к появлению боли.
- Положительный симптом Бонне-Бобровниковой – боль при пассивном приведении и ротации внутрь бедра.
- Положительный симптом Гроссмана (спазматическое сокращение ягодичных мышц при поколачивании по верхнекрестцовым и нижнепоясничным остистым отросткам).
- Появление боли по ходу седалищного нерва при поколачивании по ягодице.
В качестве диагностического теста используют также инъекцию новокаина в толщу грушевидной мышцы. Значительное облегчение боли – признак, свидетельствующий о клинически значимом спазме.
Для дополнительного обследования пациента используют ЭМГ (для выявления нейропатических и миопатических компонентов), КТ/МРТ, рентгенографию. Но основная роль в повседневной диагностике синдрома грушевидной мышцы все же отводится клиническим тестам.
Принципы лечения
Лечение синдрома грушевидной мышцы включает медикаментозные и немедикаментозные меры. При вторичном мышечном спазме необходимо воздействовать на первичное заболевание, по возможности максимально корректируя его проявления.
Медикаментозная терапия включает применение НПВС, миорелаксантов, препаратов для улучшения микроциркуляции, анальгетиков. При стойком и выраженном болевом синдроме и двигательных нарушениях показано проведение лечебной блокады. При этом брюшко спазмированной грушевидной мышцы инфильтрируют анестетиком. Нередко для блокад применяются и глюкокортикостероидные препараты, предпочтительно двухфазного действия (с быстрым и пролонгированным компонентом). Их введение позволяет уменьшить выраженность отека и воспаления в самой мышце и в оболочках седалищного нерва.
Возможно также использование компрессов с димексидом, кортикостероидным препаратом и анестетиком. Их накладывают на 30 минут на ягодично-крестцовую область в проекции спазмированной мышцы и проходящего под нею ущемленного седалищного нерва.
Важными компонентами комплексной терапии являются также массаж, физиопроцедуры, мануальная терапия с использованием постизометрической и постреципроктной релаксации мышц, рефлексотерапия на основе иглоукалывания, вакуумной и лазерной акупунктуры. Проводимые с помощью инструктора ЛФК упражнения направлены на расслабление грушевидной мышцы и одновременную активацию ее антагонистов. Такие меры дополняют действие препаратов, позволяя сократить период лечения и избежать применения чрезмерно высоких доз средств с обезболивающим действием.
Для предупреждения рецидива синдрома грушевидной мышцы необходимы рациональное лечение первопричины, коррекция сформировавшихся патологических двигательных стереотипов, ЛФК. Пациенту может потребоваться помощь вертебролога, остеопата, ортопеда и других специалистов.
doctor-neurologist.ru
Катадолон в лечении боли в спине
Проф. Я. И. Левин, К. Н. Стрыгин, Л. Е. Добровольская
Боль — одна из основных причин, заставляющих пациента обращаться к врачу. Среди болевых синдромов основную массу составляют боли в спине. Частота болевых синдромов в спине в популяции очень высока и составляет 58-84%, поэтому говорят о неинфекционной эпидемии болей в спине, возникновение которой связано с возрастающими нагрузками на человека. Социально-экономические потери огромны. По данным ВОЗ эти цифры в 2000 г. составляли 25-85 миллиардов долларов в США и 6 миллиардов фунтов стерлингов в Великобритании, что позволяет отнести это заболевание к одним из самых дорогостоящих. Особенностью болевых синдромов в спине является сочетание рефлекторных мышечно-тонических и миофасциальных синдромов с изменениями в эмоциональной сфере, способствующими хронизации состояния.
Исключительно широкая распространенность болевых синдромов диктует необходимость поиска и разработки новых путей эффективного купирования болевых ощущений и, по возможности, устранения причин, вызывающих боль. Принципиально важным является своевременное и адекватное лечение острого болевого синдрома с целью предупреждения хронизации патологического состояния. К сожалению, назначение обезболивающих и противовоспалительных препаратов значительно повышает вероятность осложнений, в первую очередь — со стороны желудочно-кишечного тракта, в особенности при наличии сопутствующих факторов риска. Вследствие этого вполне понятен интерес к поиску новых препаратов, обладающих высокой клинической эффективностью при относительно невысоком риске побочных эффектов. В этой связи представляется достаточно перспективным препарат катадолон (флупиртин), обладающий широким спектром ценных фармакологических свойств.
Катадолон является прототипом нового класса лекарственных препаратов SNEPCO («Selective Neuronal Potassium Channel Opener» — селективных активаторов нейрональных калиевых каналов). По своим фармакологическим эффектам препарат представляет собой неопиоидный аналгетик центрального действия, не вызывающий зависимости и привыкания. Химически катадолон относится к группе производных триаминопиридинов. Катадолон оказывает анальгетическое, миорелаксирующее и нейропротективное действие.
Эти свойства основаны на непрямом антагонизме катадолона по отношению к NMDA (N-метил-О-аслартат) рецепторам, активации нисходящих механизмов модуляции боли и ГАМК-ергических процессов. Ведущими механизмами действия препарата являются подавление активности NMDA-рецепторов, что приводит к снижению внутриклеточной концентрации ионов кальция [14], и воздействие на трансмембраниый транспорт ионов калия [20].
Анальгетическое действие катадолона основано на активации потенциалнезависимых калиевых каналов, что приводит к стабилизации мембранного потенциала нервной клетки и торможению возбуждения нейрона в ответ на ноцицептивные стимулы. Также установлено, что влияние на ток ионов калия опосредовано воздействием препарата на систему регуляторного G-белка, причем эффект развивается при терапевтических концентрациях препарата, достижимых в клинических условиях [19]. Сдерживание формирования ноцицептивной сенситизации и феномена «wind up» предотвращает усиление боли, переход её в хроническую форму, а при уже имеющемся хроническом болевом синдроме ведет к снижению её интенсивности. Катадолон воздействует на различные звенья системы восприятия боли, в частности, на спинальном и супраспинальном (таламическом) уровнях [1,2]. Имеющиеся на сегодняшний день результаты экспериментальных исследований убедительно свидетельствуют о том, что обезболивающее действия катадолона не связано с взаимодействием с системой опиатных и бензодиазепиновых рецептов, а также метаболизмом арахидоновой кислоты и подавлением синтеза простагландинов [3,4,13]. Отсутствие подавления синтеза простагландинов представляется исключительно важным свойством катадолона, т.к. вследствие этого он не оказывает влияния на состояние слизистой желудочно-кишечного тракта, кроме того, применение его не связано с такими осложнениями использования нестероидных противовоспалительных средств, как синдром Лайела, панцитопенмя, агранулоцитоз [7,21].
Миорелаксирующее (антиспастическое) действие катадолона на поперечно-полосатую мускулатуру опосредовано блокированием передачи возбуждения на мотонейроны и промежуточные нейроны. Кроме того, миорелаксируюший эффект может быть связан со стимуляцией ГАМК-рецепторов [23]. Катадолон снимает региональный мышечный спазм, связанный с болью, при этом не влияет на общий мышечный тонус.
Нейропротективные свойства препарата обусловливают защиту нервных структур от токсического действия высоких концентраций ионов внутриклеточного кальция, что связано со способностью катадолона вызывать блокаду нейрональных ионных кальциевых каналов и снижать внутриклеточный ток ионов кальция. Имеются данные об использовании нейропротективного эффекта катадолона в условиях ишемии головного мозга, его токсического поражения [15,18].Считается также, что катадолон обладает и антиоксидантным действием [6].
После приема внутрь катадолон быстро и практически полностью (до 90 %) всасывается в желудочно-кишечном тракте. Период полувыведения из плазмы крови составляет около 7 часов (10 часов для основного вещества и метаболита Ml), что является достаточным для обеспечения обезболивающего эффекта. У пациентов в возрасте старше 65 лет период полувыведения препарата увеличивается до 14 часов при однократном приеме и до 18,6 часов при приеме в течение 12 дней, максимальная концентрация препарата в плазме крови соответственно в 2-2,5 раза выше, чем у лиц молодого возраста. В целом концентрация действующего вещества в плазме крови пропорциональна дозе. Препарат метаболизм руется в печени, выводится из организма преимущественно почками (69 %), небольшая часть — с желчью и калом.
Эффективность катадолона была установлена в ходе исследований, проведенных в ряде стран Западной Европы и удовлетворяющих принципам доказательной медицины (рандомизированные мультицентровые исследования) [5,8]. Эффективность препарата сравнивалась с плацебо или известными обезболивающими препаратами. Установлено, что катадолон эффективен у больных с острыми и хроническими болевыми синдромами, обусловленными различными причинами — оперативным вмешательством [16], онкологическими заболеваниями [19], мигренью [11], заболеваниями опорно-двигательного аппарата [10,12], головной болью напряжения [22], остеопорозом [17]. Катадолон характеризуется хорошей переносимостью.
Нами было проведено открытое несравнительное исследование с целью оценки эффективности и безопасности препарата катадолон (производитель — фирма «Плива») у пациентов дорсопатиями с алгическими синдромами в спине.
Материал и методы исследования.
Материал исследования: исследовано 40 пациентов в возрасте от 30 до 75 лет (средний возраст 53 года) с болями в спине длительностью более 7 дней и интенсивностью 4-8 баллов по ВАШ (визуальная аналоговая шкала).
Методы исследования:
- Клинический: клинико-неврологическая оценка больных и заполнение индивидуальной клинической карты пациента с хронической болью (фирма «Плива»).
- Анкетные:
2.1. Визуальная аналоговая шкала (ВАШ).
2.2. Анкета балльной оценки субъективных характеристик сна. Максимальная суммарная оценка — 30 баллов. 22 и более баллов — это показатели, характерные для здоровых испытуемых, 19-21 балл — пограничные значения, а показатели менее 19 баллов — признак неблагополучия. Эта анкета также удобна для оценки эффективности снотворных лекарственных и нелекарственных методов лечения.
2.3. Шкала сонливости Ерworth (норма — не более 5-ти баллов).
2.4. Госпитальная шкала тревоги и депрессии: 0-7 баллов — отсутствие достоверно выраженных симптомов тревоги/депрессии; 8-10 баллов — субклинически выраженная тревога/депрессия, 11 баллов и выше — клинически выраженная тревога/депрессия.
2.5. Опросник «Качества жизни» в модификации для пациентов с болью.
- Альгометрия. Использовался прибор «Algometer commander» для верификации уровня болевых ощущений с порогом болевой чувствительности и оценки их динамики. Измерения осуществляли в безболезненном отделе спины, в максимально болезненной части спины и в проекции грушевидных мышц, справа и слева в симметричных точках. Альгометр регистрировал силу давления в футах, при которой появлялось болевое ощущение.
- Статистический анализ полученных данных с помощью непараметрических и параметрических методов статистики.
Схема исследования.
Пациенты исследовались с применением вышеуказанных методов в фоне, на 7-8 дни приема и после 14-дневного курса лечения катадолоном. Если боль прошла ранее указанных временных пунктов, то исследование проводилось на следующий день после прекращения боли. Доза препарата составляла 300 мг в сутки ( по 100 мг три раза в день) с возможным увеличением до 600 мг в сутки, при условии, что боль не снизилась на 4-й день приема препарата.
Результаты исследования.
Исследование осуществлялось на базе неврологического отделения КГБ № 33 г. Москвы. Средняя длительность заболевания пациентов составила 6,9 года. Больные отмечали по 3,3 обострения в год, длительность последнего обострения заболевания в среднем составляла 71 день.
На момент первичного осмотра у 77,5% пациентов болевой синдром локализовался на пояснично-крестцовом уровне, у 15% — на шейно-грудном, и у 7,5% боль носила распространенный характер. При этом в 37,5% случаев болевой синдром преобладал справа, в 22,5% — слева, и в 40 % не имел четкой латерализации. Симптом Ласега отмечался у 26 больных (65%), боковое сгибание и сгибание вперед было ограничено и болезненно в 90% случаев. Кроме того, у 45% пациентов был выявлен мышечно-тонический сидром, у 10% — чувствительные расстройства, у 15% — анизорефлексия, и у 27,5% больных наблюдалось сочетание вышеперечисленных симптомов.
34 пациента (85%) в предшествующие 3 месяца проводили терапию основного заболевания (дорсопатии). Из них 24 человека (60%) применяли нестероидные противовоспалительные средства, 1 (2,5%) — миорелаксанты и 9 пациентов (22,5%) получали комплексное лечение. Длительность терапии в среднем составляла 32 дня (от 5 до 90 дней). В результате проводимого лечения 16 человек отметили улучшение своего самочувствия, 9 человек (22,5%) оценили эффект терапии как сомнительный и 9 пациентов (22,5%) считали ранее проводимую терапию неэффективной. Переносимость предшествующей терапии 21 больных (52,5%) расценивали как хорошую и 13 (32,5%) — как удовлетворительную.
В 80% случаев пациенты имели сопутствующие заболевания: у 7 человек (17,5%) в анамнезе была язвенная болезнь желудка или 12-перстной кишки, 25 больных (62,5%) страдали гипертонической болезнью, 15 человек (37,5%) ИБС, 45% имели ряд других хронических соматических заболеваний. Терапию сопутствующих заболеваний проводили 75% пациентов, её средняя длительность составляла 11 лет (от полугода до 30 лет).
До начала терапии катадолоном в ходе клинико-неврологического исследования у 26 пациентов (65%) был выявлен симптом Ласега, 35 больных (87,5%) отмечали затруднения и возникновение боли при наклоне туловища вперед и боковом сгибании. Мышечно-тонический синдром наблюдался у 18 пациентов (45%), чувствительные расстройства у 4 (10%), и анизорефлексия у 6 больных (.15%). После терапии катадолоном отмечено уменьшение представленности и выраженности симптомов дорсопатии. Так, у 8 пациентов (20%) ранее выявленные симптомы регрессировали полностью, в 37,5% случае в симптом Ласега стал отрицательным, затруднения и возникновение боли при наклоне туловища вперед и боковом сгибании перестали отмечать 25% больных, мышечно-тонический синдром был купирован у 33% пациентов.
Под влиянием препарата значительно уменьшилась выраженность болевого синдрома, улучшилось общее состояние больных (Табл. 1).
Таблица 1. Динамика интенсивности болевого синдрома по ВАШ в процессе и после лечения катадолоном.
| Оценка боли пациентом по ВАШ | 68,7 | 56,3* | 38,8* |
| Оценка общего состояния врачом по ВАШ | 61,9 | 57,1 | 47,7 |
* — достоверные (р
katadolon.paininfo.ru
Применение препарата Катадолон в лечении болевых синдромов при радикуломиелоишемии
Грибова Н.П. Кафедра неврологии и психиатрии ФПК и ППС, медицинская академия, г. Смоленск
Радикуломиелоишемия (РМИ) — это медленно прогрессирующий спинально-корешковый сосудистый процесс на шейном, грудном или поясничном уровнях В начальных стадиях заболевания у 35% больных диагноз ставится неправильно. (Скоромец А.А., 1981).Это связано со сложностью дифференциальной диагностики начальных проявлений РМИ, проявляющейся лишь при повышенной потребности спинного мозга в притоке крови, и выявляющейся с помощью специальных методов обследования (Шмидт Е.В., 1975). Причинами РМИ являются поражение сердечно-сосудистой системы (18%), хирургические вмешательства (7,6%), но наиболее часто (72,2%) причина РМИ — это патология позвоночника. При этом оправданным с клинико-морфологической точки зрения можно считать выделение следующих форм поражения позвоночника: 1) дегенерация межпозвонковых дисков; 2) протрузии и грыжевые выпячивания; 3) деформирующий спондилез передней и задней продольных связок; 4) деформирующий спондилоартроз.
Несмотря на постоянно меняющийся взгляд на роль «остеохондроза» в формировании разнообразных неврологических синдромов, к настоящему времени сформировалась четкая доминанта о преобладающей роли именно остеохондроза в формировании различных болевых синдромов. Проведенные многочисленные исследования болевых синдромов различной локализации выявили достаточно полярные результаты анализа связи дегенеративно-дистрофических изменений и алгических реакций. Так при наличии корешкового синдрома остеохондроз соответствующего межпозвоночного диска был выявлен у 23,7% больных, у 76,3 — боль не совпадала с зоной иннервации дерматома (Скоромец А.А., 1997). Вопрос связи болевых синдромов при РМИ с патологией позвоночника является важным, но на этапе начальных проявлений этой патологии — далеко не основным. Нами было установлено, что в случае РМИ на шейном уровне боль той или иной интенсивности характерна.. В случаях спастико-амиотрофической формы РМИ она была в дебюте заболевания в 100%, случаев, при спастическом и амиотрофическом синдромах — в 70% (Грибова Н.П., 1993).
Смена ирритативно-рефлекторной стадии, которой присуще постепенное развитие на фоне преобладания сенсорно-алгических признаков с соответствующим минимальным нарушением двигательных и чувствительных функций, дефицитарно-ирритативной фазой заболевания с уже выраженными корешковыми, невральными и спинальными явлениями ставит решение вопроса о ранней патогенетически оправданной терапии РМИ более важным и принципиальным, чем диагностирование «остеохондроза» как такового.
Методом, позволяющим с высокой степенью надежности уточнить состояние корешково-сегментарного аппарата спинного мозга с учетом функциональной активности интернейронов и состояния надсегментарного контроля является электронейромиография (ЭНМГ).
Используемая нами программа обследования больных с синдромами РМИ включает изучение феноменов, получаемых с помощью поверхностного отведения и стимуляционных методик. Суммарная биоэлектрическая активность мышц оценивается визуально: определяется степень насыщения интерференционных кривых в покое и при максимальном напряжении, соотношение активности мышц антагонистов предплечья при попеременном сгибании-разгибании. Методом игольчатой ЭМГ выявляется наличие и характер спонтанной активности, определяется средняя длительность потенциалов ДЕ, строится гистограмму для определения стадии денервационно-реиннервационного процесса по Б.М. Гехту. Методом стимуляционной ЭМГ изучается скорость проведения (СПИ эфф.) с двух сторон в дистальных и проксимальных сегментах. В том числе по латенции F-волны — состояние корешкового проведения( Kimura1992). При этом оценивается форма, амплитуда и латентный период М- и F- волн. Анализируется период молчания в мышцах кисти в ответ на раздражение одиночным импульсом прямоугольной формы эфферентных волокон периферических нервов при произвольном напряжении мышц. Исследование рефлекторных ответов проводится на верхних и нижних конечностях ( в зависимости от уровня РМИ — шейного или поясничного).
Особое значение в наших исследованиях придается изучению рефлекса Hoffman(а) или Н-рефлекса. Н-рефлекс представляет собой моносинаптический рефлекторный ответ мышцы при электрическом раздражении нервного ствола. При оценке параметров Н-рефлекса используются известные параметры — латенция, порог, изменение амплитуды при увеличении силы стимуляции, с расчетом соотношения амплитуды Н-рефлекса к амплитуде моторного ответа, так называемый Н/М коэффициент). Анализ параметров Н-рефлекса позволяет оценить состояние корешково-сегментарного аппарата спинного мозга (афферентной и эфферентной его части) в исследуемой сегментарной зоне , нарушение синаптического проведения (в норме задержка 1 мс) и состояние супраспинального контроля за сегментарной деятельностью спинного мозга (Бадалян Л.О., 1986).
С учетом известных факторов патофизиологии боли (сенситизация ноцицепторов, невральная эктопия и центральная сенситизация (Кукушкин М.Л., 2003)) большой интерес представляют механизмы вторичной гипералгизии. Ее формирование связано с изменением функциональной активности ноцицептивных нейронов в задних рогах спинного мозга при непосредственном участии интернейронов. Доказано, что сенситизация ноцицептивных нейронов сопровождается увеличением их спонтанной активности. Формирующаяся в дальнейшем цепочка патологических ноцицептивных реакций происходит с участием как периферических ноцицептивных структур, так и соматосенсорной зоны коры. Важным звеном, запускающим афферентно-эфферентную дезинтеграцию на уровне сегмента спинного мозга, является состояние активности низкопороговых афферентов 1А типа, функциональная активность интернейронов, обеспечивающих внутрисегментарное торможение и реакция мотонейронов.
Собственные клинико-ЭНМГ обследования больных с синдромом РМИ на шейном уровне позволило установить следующее: пусковым фактором на начальном этапе формирования клиники (т.е. на фоне преобладающих жалоб алгического и вегетативно-дистонического характера без значительного сенсо-моторного и рефлекторного дефицита) является изменение функции интернейронов. Это вносит изменения в механизм возвратного торможения с формированием патологической активности мотонейрона. В дальнейшем при четком клиническом оформлении синдрома РМИ признаки афферентно-эфферентной дисфункции продолжали нарастать вплоть до ЭНМГ-признаков корешковой компрессии, нарушения надсегментарного контроля и нарушения механизмов внутрисегментарного торможения (Грибова Н.П., 1993).
Терапевтические подходы в лечении больных с синдромами РМИ отличаются разнообразием в подходах как на этапе начальных проявлений, так и в случае клинически оформленного синдрома.
Важным для клинициста является как факт купирования болевого синдрома, так и возможность патогенетического лечения, направленного на предотвращение прогрессирования заболевания. Прогрессирование заболевания целиком и полностью определяется состоянием спастичности, которая является тем симптомокомплексом, который отмечается особой проградиентностью. Препарат Катадалон (флупиртин) является представителем нового класса препаратов — неопиоидного центрального действия, обладает миорелаксирующим действием. В отличие от традиционно применяемых обезболивающих средств (кислотных болеутоляющих/антиревматических веществ, опиоидных анальгетиков), он не ингибирует циклооксигеназу, не обладает опиоидным действием и, следовательно, свободен от присущих этим веществам побочных действий. Механизм действия флупиртина установлен лишь недавно. Он является прототипом нового класса обезболивающих веществ, и его особые свойства объясняются именно этим. Он обладает сочетанием болеутоляющих и миорелаксирующих свойств, что особенно важно при лечении опорно-двигательного аппарата и мышечных спазмов.
Исследования флупиртина показали непрямой функциональный антагонизм с NMDA-рецепторами. Было также показано, что прямого влияния на эти рецепторы флупиртин не оказывает. Кроме того, установлено, что изменение болевого восприятия происходит и через нисходящую норадренергическую систему. Многосторонние экспериментальные исследования дополнили эти сведения еще и данными о нейропротективном действии флупиртина.
Все это указывает на то, что флупиртин обладает тройным действием: обезболивающим, миорелаксирующим и нейропротективным, которые основаны на непрямом антагонизме NMDA-рецепторам с усилением эндогенных нисходящих механизмов модуляции болевого ощущения и торможении GABA-эргических процессов.
В последние два года удалось, наконец, раскрыть функциональные взаимосвязи трех составляющих действия флупиртина: анальгезии, миорелаксации и нейропротекции. Выяснилось, что в терапевтических дозах флупиртин — избирательный открыватель ионных калиевых каналов нейронов (selective neuronal potassium channel opener — SNEPCO).
Флупиртин открывает К+ каналы, помогающие нейрону вернуться в состояние покоя. Прекращается поступление ионов Са2+ в клетку, Mg2+ вновь блокирует NMDA-рецептор. То есть опосредованно подавляется активация NMDA-рецепторов. Происходит стабилизация мембранного потенциала и снижение возбудимости нейронов. Передача импульса в головной мозг и на мотонейроны не происходит. Все это обеспечивает фармакодинамическое действие флупиртина на афферентные ноцицептивные процессы нейрона, что вызывает соответствующие клинические проявления:
- подавление ноцицептивного возбуждения (обезболивающее действие)
- подавление ноцицептивной сенсибилизации
- препятствие превращению острого болевого процесса в хронический
- подавление сочетающегося с болью мышечного спазма
- нейропротективное действие (защита от цитотоксического действия чрезмерно возросшей концентрации свободных ионов Ca2+)
Нами препарат Катадолон назначался больным, имеющим хроническое течение болевого синдрома поясничной локализации и клиническими признаками радикуломиелоишемии. ЭНМГ обследование выявило признаки сенсо-моторной радикулопатии в сегментах L5-S1, (блоки антидромной стимуляции с сегмента L5-S1 более 80%, снижение скорости проведения по корешку — более 50% от нормы), признаки пирамидного синдрома с усилением интернейрональных тормозных механизмов(Н/М коэффициент более 70% с камбаловидной мышцы).
При изучении состояния внутрисегментарного торможения нами использовалась методика оценки кривой восстановления Н-рефлекса, предложенная Magladery. При интервале в несколько миллисекунд определяется период период раннего облегчения второго Н-рефлекса, что объясняют возбуждением мотонейронов подпороговой каймы, для которых первый стимул оказался подпороговым, но повысил их возбудимость, подготовив к ответу на второй стимул. Затем при интервале 50-100 мс наблюдается депрессия второго Н-рефлекса с резким снижением его амплитуды, связанным со следовой невозбудимостью мотонейронов после первого ответа и включением интернейронных тормозных воздействий при первом сокращении мышцы. Следующий период, период промежуточного облегчения, наступает при интервале 150-200 мс после первого стимула: амплитуда второго Н-рефлекса вновь повышается, иногда довольно значительно, что обусловлено активацией интерсегментарных и супрасегментарных облегчающих влияний. Вслед за промежуточным облегчением регистрируется поздняя депрессия второго Н-рефлекса со снижением его амплитуды до 15-20%. Этот период соответствует межстимульному интервалу 250-450 мс и обусловлен, так же как и ранняя депрессия, пресинаптическим торможением 1А афферентов. При интервале между двумя стимулами, превышающими 1 с, влияние первого стимула на величину амплитуды второго Н-рефлекса обычно уже минимально.
Анализ кривой восстановления Н-рефлекса показал усиление функции интернейронов на уровне поясничных сегментов (II период кривой восстановления Н-рефлекса более 60%) с изменением пресинаптического торможения 1А афферентов (III период кривой восстановления Н-рефлекса менее 30%).
После курсового назначения катадолона (300 мг) в течение не менее 10 дней все больные отметили клиническое улучшение, в первую очередь за счет уменьшения спастичности, при этом уменьшение интенсивности болевого синдрома было также существенным, что в целом обеспечивало хорошую двигательную функцию пациентов. Контрольное ЭНМГ обследование показало, что при достаточно стойких изменениях в параметрах F-волн произошла нормализация афферентно-эфферентных взаимоотношений на уровне поясничных сегментов за счет изменения пресинаптического торможения 1А афферентов. Клинически у больных РМИ уменьшилась интенсивность боли и сформировалась стойкая тенденция к нормализации тонуса (уменьшение).
Курсовое назначение препарата катадолон делает его применение патогенетически оправданным и перспективным в лечении синдромов РМИ.
Литература
- Бадалян Л.О., Скворцов И. А. Клиническая электронейромиография. — М.: «Медицина». — 1986.
- Грибова Н. П. Патогенез, клиника и лечение начальных форм цервикальной радикуломиелоишемии. Дисс. ... канд. мед. наук. — 1993.
- Грибова Н. П. Центральные и периферические механизмы регуляции движений мимической мускулатуры при двигательных расстройствах в области лица (клинико-электронейромиографический анализ) // Вестник СГМА. — Смоленск, 2000.
- Кукушкин М. Л. Неврогенные болевые синдромы // Журн. «Боль». — № 1. — 2003.
Источник: «Головная боль» 9 2005
katadolon.paininfo.ru
Катадолон при синдроме грушевидной мышцы
Многие годы пытаетесь вылечить СУСТАВЫ?
Глава Института лечения суставов: «Вы будете поражены, насколько просто можно вылечить суставы принимая каждый день...Читать далее »
Синдром грушевидной мышцы – разновидность болевого синдрома, вызванного ущемлением седалищного нерва из-за спазма грушевидной мышцы.
Спазм приводит к укорочению и уплотнению мышечных волокон, это ограничивает ротационные движения бедра, болевые ощущения распространяются на паховую область, по ноге до колена, в поясничный отдел.
Такое нейротрофическое спазмирование вызывается раздражением первого крестцового корешка спинно — мозгового нерва .
Особенности строения грушевидной мышцы
Мышца имеет треугольную форму. Одной вершиной крепится к большому вертелу в области его верхушки сухожилием, далее проходит сквозь большое седалищное отверстие и крепится тремя равномерными пучками к крестцу, между первым и четвертым крестцовыми отверстиями.
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для лечения суставов наши читатели успешно используют СустаЛайф. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию. Подробнее здесь…
Над мышцей остается капсула крестцово-подвздошного сустава, а под ней находится передняя поверхность крестцово-бугорной связки. Совместно с мышцей через седалищное отверстие проходит пучок сосудов и седалищный нерв.
Грушевидная мышца необходима для обеспечения следующих функций:
- ротационные движения бедра в наружном направлении;
- ртабилизации тазобедренного сустава;
- для удержания головки бедренной кости внутри вертлюжной впадины;
- для осуществления наклонов вперед, при неподвижных нижних конечностях.
Причины возникновения синдрома
Спектр причин развития данного болевого синдрома весьма широк. Принято группировать причины по непосредственному источнику синдрома.
Первичные
При первичных причинах синдрома грушевидной мышцы раздражитель применяется непосредственно к мышце:
- Травма в ягодичной либо поясничной области (ушиб может вызвать гематому, повреждение мышечной ткани, что в свою очередь приведет к раздражению корешка спинно-мозгового нерва).
- Растяжение или сильное напряжение грушевидной мышцы. Часто при чрезмерных физических нагрузках, либо в результате резкого изменения положения.
- Миозит мышцы. Воспалительный процесс может стать причиной возникновения резкого болевого синдрома.
- Переохлаждение. При воздействии холода мышца сокращается гораздо сильнее, пытаясь спродуцировать выработку как можно большего количества АТФ. Такая интенсивность может привести к перенапряжению мышцы.
- В результате некачественно введенной инъекции. Может быть задет корешок нерва.
Вторичные
Причины опосредованно влияющие на мышцу, но тем не менее приводящие к возникновению синдрома: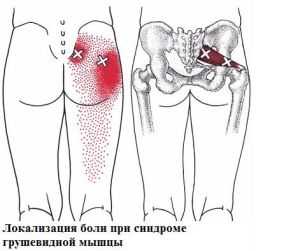
- Патологии органов малого таза. Воспаление может распространиться на рядом расположенные органы, в том числе мышцы.
- При нарушениях в соединительных структурах крестца и подвздошной кости.
Другая классификация причин учитывает отношение к позвоночному столбу.
Вертеброгенные
- если причина прямо или косвенно связана с частями позвоночника;
- травмы спинного мозга, позвоночника и т.д;
- сужение межпозвоночных отверстий;
- развитие опухолевых образований на частях позвоночника;
- проявления радикулита в поясничном отделе позвоночника.
Невертеброгенные
- происходят патологические процессы внутренних органов;
- нарушается функционирование мышечного аппарата данной области.
Симптоматика, присущая синдрому
Проявления данного синдрома могут быть либо локальными (болезненные ощущения возникают в непосредственной близости к грушевидной мышце, локализуются в определенной области; связаны со спазматическими явлениями в мышце).
В том случае, когда симптомы указывают на нарушение иннервации тех или иных частей, говорят о признаках сдавливания седалищного нерва. А если нарушения носят характер недостаточного питания органов, тогда эти симптомы синдрома грушевидной мышцы классифицируют, как признаки компрессии артерий и сосудов.
Локальные симптомы
К локальным признакам относятся:
- Болевые ощущения в области ягодичной мышцы, либо в крестцово-подвздошном суставе, либо в тазобедренном суставе. Болевые ощущения усиливаются при движениях, в которых принимает непосредственное участие грушевидная мышца.
- Симптом Бонне-Бобровниковой. Заключается в полном расслаблении ягодичной мышцы, в таком состоянии можно прощупать уплотненную грушевидную мышцу, при надавливании возникает боль.
- Симптом Виленкина – при постукивании в районе грушевидной мышцы возникает боль.
При прикосновении, ощущается болезненность седалищной кости.
Признаки сдавливания седалищного нерва
Т.к. седалищный нерв иннервирует многие структуры нижней конечности, то и его защемление нарушает их функции:
- распространение болевых ощущений по всей ноге;
- боль сопровождается ощущением одеревенения, жжения;
- симптомом может стать угнетение ахиллова рефлекса;
- если защемлены волокна, образующие большеберцовый нерв, то болевые ощущения локализованы в двуглавой мышце голени.
- возникает онемение пальцев нижней конечности;
- побледнение кожных покровов;
- возникают приступы хромоты, вынуждающие остановить движение и через некоторое время в покое кровоток восстанавливается и снова возможно движение.
Как только пациент заходит в кабинет врача на диагностику, последний отмечает особенности походки, осанки и характерные движения.
Для достоверной диагностики синдрома грушевидной мышцы пациент подвергается целому ряду исследований. Среди них:
- Проверяется наличие симптома Бонне – Бобровниковой.
- Простукивают ногу на предмет симптома Виленкина.
- Простукивают по нижним поясничным или верхним крестцовым остистым отросткам. В случае сокращения ягодичной мышцы говорят о положительном симптоме Гроссмана.
- Проводят пальпацию мест прикрепления грушевидной мышцы – район большого вертела бедренной кости и крестцово-подвздошное сочленение. Положительный результат – возникновение болевых ощущений.
- Тестирование состояния подвздошно-крестцовой и крестцово-остистой связок.
- Как метод диагностики используют трансректальную пальпацию грушевидной мышцы. В том случае, если мышца определяется упругой и болезненной, результат считается положительным.
- Метод исключения. Непосредственно в грушевидную мышцу вводится раствор анестетика (его вид зависит от индивидуальной переносимости), и если болевые симптомы исчезают, делают выводы о наличии синдрома грушевидной мышцы.
Если имеется подозрение на наличие данного синдрома, как сопутствующего какому – либо заболеванию (онкология, травма позвоночника), назначаются специфические инструментальные методы:
- компьютерная томография;
- рентгенологическое исследование пояснично-крестцового отдела;
- радиоизотопное сканирование (в случае подозрения на наличие опухолевых образований).
Принципы лечения
Все методы лечения при синдроме грушевидной мышцы , которые используются должны быть направлены на лечение причины возникновения данного болевого синдрома. Лечение всегда системно и комплексно.
Медикаментозные
Медикаментозное лечение синдрома грушевидной мышцы включает в себя:
- для расслабления, снижения болевых синдромов вводятся миорелаксанты;
- нестероидные противовоспалительные препараты;
- анальгетики при сильных болевых ощущениях;
- препараты для улучшения кровообращения. Уменьшают воспаление, помогают в возобновлении иннервации.
Мануальная терапия
Методика разрабатывается индивидуально. Часто применимы такие:
- постизометрическая релаксация мышц;
- постреципрокная релаксация мышц.
Физиотерапия
Основные физиотерапевтические процедуры включают:
- магнитно-лазерная терапия;
- электрофорез.
Рефлекторные методы
Среди основных:
- лазерная акупунктура;
- вакуумная терапия;
- фармакопунктура;
- иглорефлексотерапия и др;
- лечебный массаж.
Блокада грушевидной мышцы
В том случае, если напряжение грушевидной мышцы длится довольно длительный период времени, вызывая при этом целый ряд неприятностей, в рамках лечения проводят блокаду мышцы анестетиком.
Для этого в положении лежа намечают три основные точки: седалищный бугор, вершину большого вертела и задневерхнюю ость подвздошной кости и соединяют в виде треугольника. Из последней точки проводят линию так, чтобы угол был разделен на две равные части. Данную линию условно дробят на три части и на границе нижней и средней части делают отметку.
В этой области делают местную анестезию соединительных тканей, после чего вводят иглу так, чтобы попасть в брюшко грушевидной мышцы. И вводят анестетик.
Гимнастические упражнения
Расслабить мышцу, снимать боль и восстанавливать должную двигательную активность можно с помощью физических упражнений.
- Выполняется движение коленями навстречу друг другу и в разные стороны. Выполняется плавно, лежа на спине, колени в п
олусогнутом состоянии.
- Не меняя положения, выполнять покачивающие однонаправленные движения сомкнутыми коленями.
- Движения на вставание. Из положения сидя, при сомкнутых коленях и широко разведенных ступнях совершается движение вверх, помогая сначала рукой, опираясь о сидение, а после отрыва руки, с помощью партнера завершить подъем.
Все индивидуальные упражнения поможет составить физиотерапевт, с учетом возраста, веса, физической формы и на каждом этапе лечения.
Осложнения
Своевременно не леченный, синдром может привести к следующим последствиям:
- Нарушается функционирование мышц нижней конечности;
- Появляются признаки деградации связок и функций суставов;
- Возникают проблемы с органами малого таза.
Профилактические меры
Некоторые меры, позволят избежать длительной реабилитации, и дорогостоящего лечения. Особенно это актуально для людей, которые имеют склонность к заболеваниям поясничного отдела:
- следует избегать чрезмерных физических нагрузок;
- внимательно относиться к здоровью (при первых признаках радикулита обращаться за помощью);
- избегать переохлаждений;
- стараться долго не находиться в одной и той же позе, не смотря на ее комфортность.
Возникновение синдрома грушевидной мышцы всегда сопровождается целым рядом дискомфортных ощущений, но качественная диагностика позволит начать своевременное лечение, и свести проявления к минимуму вплоть до полного выздоровления.
Видео: Рекомендации для пациентов с синдромом грушевидной мышцы
osteohondroz.taginoschool.ru
Воспаление грушевидной мышцы
Здравствуйте! Мне 20 лет, общее состояние хорошее, хронических болезней нет. Около 8 месяцев назад занималась растяжкой, достаточно интенсивно, в течении 2х недель. По окончании этих занятий почувствовала легкий неудобство в области правого тазобедренного сустава (но травмы как такой не было), и щелчки в суставе при исполнении упражнений. Через месяц по окончании больших физических нагрузок почувствовала ноющую боль в ягодице в области т/б сустава. Некоторое время меня безуспешно лечили от коксартроза — физиолечение, массаж, НПВС, Алфлутоп. После этого на КТ тазобедренного сустава — патологий не было распознано, т. е. вроде не коксартроз. Невролог поставил диагноз — «синдром грушевидной мускулы, вероятно кроме этого повреждение суставно-связочного аппарата из-за перерастяжения». МРТ пояснично-крестцового отдела позвоночника не продемонстрировала явных отклонений, позвоночник в порядке. Пропила пара курсов миорелаксантов (Сирдалуд, Мидокалм), на 6 месяцев отказалась от физических нагрузок. Миорелаксанты сняли боль до минимума, но неприятные тянущие ощущения при ходьбе в ноге остались. Наружные средства, мази не оказывают помощь. Боль «мигрирует» по ягодице — время от времени болит в области крестца, время от времени у тазобедренного сустава, время от времени внизу ягодицы. Вниз по ноге не отдает. Чувствительность в ноге не нарушена, по ночам и в состоянии спокойствия болей нет, нога не опухает. Через полгода неспешно в центре правой ягодицы появилась продолговатая ямка — атрофия мыщц. При любых попытках возвратиться кроме того к маленьким физическим нагрузкам (гимнастика, танцы) боль улучшается, но не сходу (по окончании 3х-4х занятий). Сравнительно не так давно была у невролога — невролог не глядя снова выписала Мидокалм, не пологаю, что он окажет помощь. Посоветуйте, пожалуйста, что еще возможно сделать для лечения, не хочется отказываться от движения и физкультуры. Вправду ли у меня это заболевание?
Здравствуйте! Обстоятельствами болей значительно чаще являются: Артроз (коксартроз); Воспаление бедренных сухожилий; Синдром грушевидной мускулы; Ревматическая полимиалгия. Коксартроз начинается медлительно, незначительные боли, каковые чувствуются лишь при ходьбе, неспешно усиливаются. Больше всего боль чувствуется в паху и в области бедра больной ноги. Такие симптомы не разрешают начать лечение на ранней стадии болезни. После этого появляется хруст в суставе, хромота и укорочение больной ноги, атрофия мышц бедра, отмечание явное ограничение подвижности тазобедренного сустава. Обострения болезни смогут наступить по окончании неудачного движения, тяжелой нагрузки. Атрофия бедренных мышц может приводить к болям в колене, каковые время от времени тревожат больше, чем боли в бедре и, тем самым, запутывают картину болезни. Обстоятельствами коксартроза значительно чаще являются: перегрузка сустава; перегрузка ног у полных людей; травматизация сустава; воспаление суставов (артрит).Советы по лечению: улучшение кровоснабжения – непременное условие эффективности лечения (сосудистые препараты, омелотерапия, электростимуляция). На этом фоне у Вас развился хронический болевой синдром — при нем назначают катадолон, антидепрессанты, антиконвульсанты. Но выбор в тактике лечения остается за неврологом либо ортопедом-ревматологом.
Консультация дается только в справочных целях. По результатам взятой консультации, пожалуйста, обратитесь к доктору.
razryd2000.ru
Катадолон при синдроме грушевидной мышцы
В данной статье можно ознакомиться с инструкцией по применению лекарственного препарата Катадолон. Представлены отзывы посетителей сайта - потребителей данного лекарства, а также мнения врачей специалистов по использованию Катадолона в своей практике. Большая просьба активнее добавлять свои отзывы о препарате: помогло или не помогло лекарство избавиться от заболевания, какие наблюдались осложнения и побочные эффекты, возможно не заявленные производителем в аннотации. Аналоги Катадолона при наличии имеющихся структурных аналогов. Использование для лечения и купирования боли у взрослых, детей, а также при беременности и кормлении грудью.
Катадолон - анальгетик центрального действия. Является селективным активатором нейрональных калиевых каналов. Не относится к опиоидам, не вызывает зависимости и привыкания.
Оказывает анальгетическое, миорелаксирующее и нейропротекторное действие, основанное на непрямом антагонизме по отношению NMDA-рецепторам, активации нисходящих механизмов модуляции боли и GABA-ергических процессов.
В терапевтических концентрациях флупиртин не связывается с альфа1-, альфа2-адренорецепторами, серотониновыми 5HT1-, 5НТ2-рецепторами, допаминовыми, бензодиазепиновыми, опиоидными, центральными м- и н- холинорецепторами.
Антиспастическое действие на мышцы связано с блокированием передачи возбуждения на мотонейроны и промежуточные нейроны, приводящим к снятию мышечного напряжения. Это действие флупиртина проявляется при многих хронических заболеваниях, сопровождающихся болезненными мышечными спазмами (скелетно-мышечные боли в шее и спине, артропатии, головные боли напряжения, фибромиалгия).
Благодаря нейропротекторным свойствам защищает нервные структуры от токсического действия высоких концентраций ионов внутриклеточного кальция, что связано, со способностью флупиртина вызывать блокаду нейрональных ионных кальциевых каналов и снижать внутриклеточный ток ионов кальция.
Состав
Флупиртина малеат + вспомогательные вещества.
Фармакокинетика
После приема внутрь практически полностью (до 90%) и быстро всасывается из ЖКТ. Выводится в основном почками (69%): 27% выводится в неизмененном виде, 28% - в виде метаболита М1 (ацетил-метаболит), 12% - в виде метаболита М2 (пара-фторгиппуровая кислота) и остальная треть состоит из нескольких метаболитов с невыясненной структурой. Небольшая часть дозы выводится из организма с желчью и калом.
Показания
Острый и хронический болевой синдром при следующих заболеваниях и состояниях:
- мышечный спазм;
- злокачественные новообразования;
- первичная альгодисменорея;
- головная боль;
- посттравматические боли;
- дорсалгия;
- цервикалгия;
- миалгия;
- боли при травматологических/ортопедических операциях и вмешательствах.
Формы выпуска
Капсулы 100 мг.
Таблетки пролонгированного действия 400 мг форте или ретард.
Инструкция по применению и режим дозирования
Капсулы
Внутрь, не разжевывая и запивая небольшим количеством жидкости (100 мл).
Взрослым: по 1 капсуле 3-4 раза в день с равными интервалами между приемами. При выраженных болях - по 2 капсуле 3 раза в день. Максимальная суточная доза - 600 мг (6 капсул).
Дозы подбирают в зависимости от интенсивности боли и индивидуальной чувствительности больного к препарату.
Длительность терапии определяется лечащим врачом и зависит от динамики болевого синдрома и переносимости. При длительном применении следует контролировать активность печеночных ферментов с целью выявления ранних симптомов гепатотоксичности.
Таблетки
Внутрь, не разжевывая и запивая небольшим количеством жидкости (100 мл), по 1 таблетке 1 раз в день. Максимальная суточная доза - 400 мг.
Если боль продолжает беспокоить, необходимо рассмотреть вопрос о дополнительной терапии другими обезболивающими средствами. Длительность терапии определяется лечащим врачом и зависит от динамики болевого синдрома и переносимости.
Во время лечения необходимо регулярно контролировать активность печеночных ферментов в сыворотке крови и концентрацию креатинина в моче.
Побочное действие
- депрессия;
- нарушения сна;
- потливость;
- беспокойство;
- нервозность;
- тремор;
- головная боль;
- спутанность сознания;
- нарушения зрения;
- головокружение;
- изжога;
- тошнота, рвота;
- запор или диарея;
- метеоризм;
- боли в животе;
- сухость во рту;
- потеря аппетита;
- повышение температуры тела;
- крапивница;
- зуд.
Противопоказания
- печеночная недостаточность с явлениями энцефалопатии;
- холестаз;
- тяжелая миастения;
- хронический алкоголизм;
- беременность;
- детский и подростковый возраст до 18 лет;
- повышенная чувствительность к флупиртину.
Применение при беременности и кормлении грудью
Противопоказан к применению при беременности.
При необходимости применения в период лактации следует решить вопрос о прекращении грудного вскармливания на период лечения, т.к. показано, что незначительное количество флупиртина выделяется с грудным молоком.
Особые указания
С осторожностью применять при нарушениях функции печени и/или почек, пациентам старше 65 лет. Пациентам этих групп требуется коррекция режима дозирования.
Побочные эффекты в основном зависят от дозы. Во многих случаях они исчезают сами по себе по мере проведения терапии или после окончания лечения.
При лечении Катадолоном возможны ложноположительные результаты теста с диагностическими полосками на билирубин, уробилиноген и белок в моче. Аналогичная реакция возможна при количественном определении уровня билирубина в плазме крови.
При применении в высоких дозах в отдельных случаях может отмечаться окрашивание мочи в зеленый цвет, что не является клиническим признаком какой-либо патологии.
У пациентов с нарушениями функцией печени или почек следует контролировать активность печеночных ферментов и содержание креатинина в моче.
При одновременном применении Катадолона с препаратами, которые также метаболизируются в печени, требуется регулярный контроль активности печеночных ферментов.
Следует избегать комбинированного применения флупиртина и лекарственных средств, содержащих парацетамол и карбамазепин.
Влияние на способность к вождению автотранспорта и работе с механизмами
Учитывая, что флупиртин может ослаблять внимание и замедлять ответные реакции организма рекомендуется во время лечения препаратом воздерживаться от вождения транспорта и занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Лекарственное взаимодействие
Флупиртин усиливает действие седативных средств, миорелаксантов, а также этанола.
В связи с тем, что Катадолон связывается с белками плазмы крови, следует учитывать возможность его вытеснения из связи с белками другими одновременно принимаемыми лекарственными средствами. В тоже время показано, что флупиртин вытесняет варфарин и диазепам из связей с белками, что при одновременном приеме с флупиртином может привести к усилению их активности.
При одновременном применении флупиртина и производных кумарина возможно повышение антикоагулянтного действия.
Аналоги лекарственного препарата Катадолон
Структурные аналоги по действующему веществу:
Аналоги по оказываемому фармакологическому эффекту (средства для купирования боли):
- Аскафф;
- Бупранал;
- ДГК Континус;
- Дексалгин;
- Диклоберл;
- Димексид;
- Дипидолор;
- Долак;
- Дюрогезик;
- Залдиар;
- Кеталгин;
- Кетанов;
- Кетонал Дуо;
- Кеторол;
- Кеторолак;
- Лидокаин;
- Метиндол ретард;
- Метиндол;
- Морадол;
- Морфин;
- Нопан;
- Промедол;
- Просидол;
- Протрадон;
- Раптен Дуо;
- Рекофол;
- Скенан;
- Стадол;
- Тиаприд;
- Тиапридал;
- Торадол;
- Трамадол;
- Трамал;
- Трамолин;
- Трамундин ретард;
- Транстек;
- Фендивия;
- Фентанил;
- Фламакс форте;
- Фламакс;
- Флугалин.
При отсутствии аналогов лекарства по действующему веществу, можно перейти по ссылкам ниже на заболевания, от которых помогает соответствующий препарат, и посмотреть имеющиеся аналоги по лечебному воздействию.
phoenix-pharma.ru